|
 |
| J Appropr Technol > Volume 7(2); 2021 > Article |
|
Abstract
AIDS ĒÖśņ×ÉļŖö ņĀä ņäĖĻ│äņŚÉ 4,000ļ¦ī ļ¬ģņØĖ Ļ▓āņ£╝ļĪ£ ņČöņé░ļÉśļ®░, ņŻ╝ļĪ£ Ļ░£ļ░£ļÅäņāüĻĄŁņŚÉņä£ ļīĆļČĆļČäņØś ĒÖśņ×ÉĻ░Ć ļ░£ņāØĒĢśĻ│Ā ņ׳ļŗż. AIDSņØś ņøÉņØĖ ļ░öņØ┤ļ¤¼ņŖżņØĖ HIVļŖö ĒśłņżæņØś CD4+ T ņäĖĒżņŚÉ Ļ░ÉņŚ╝ļÉśņ¢┤ ņłśĻ░£ņøö ļé┤ņ¦Ć 10ļģä Ļ░äņØś ņ×Āļ│ĄĻĖ░Ļ░äņØä Ļ▒░ņ╣śļ®┤ņä£ CD4+ T ņäĖĒżļź╝ ņĀÉņĀÉ ĒīīĻ┤┤ĒĢśņŚ¼ ĒÖśņ×ÉņØś ļ®┤ņŚŁĻĖ░ļŖźņØä ņĀĆĒĢśņŗ£Ēé©ļŗż. ņØ┤ļĀćĻ▓ī ļ®┤ņŚŁļĀźņØ┤ ņĢĮĒÖöļÉ£ A IDS ĒÖśņ×ÉļŖö ļŗżņ¢æĒĢ£ ļ│æņ”ØņŚÉ ņØśĒĢ┤ ņé¼ļ¦ØņŚÉ ņØ┤ļź┤Ļ▓ī ļÉ£ļŗż. Ēśäņ×¼ņØś CD4+ T ņäĖĒż ņłśļź╝ Ļ│äņĖĪĒĢśļŖö ļ░®ļ▓ĢņØĆ ĒåĄņāü ņ£ĀņäĖĒżļČäņäØ(flow cytometry) ļ░®ļ▓ĢņŚÉ ņØśĒĢ┤ ņŗ£Ē¢ēļÉśĻ│Ā ņ׳ļŗż. ņ£ĀņäĖĒżļČäņäØ ļ░®ļ▓ĢņØĆ ņĀĢĒÖĢļÅäĻ░Ć ļåÆļŗżļŖö ņןņĀÉņØ┤ ņ׳ņ£╝ļéś ņłÖļĀ©ļÉ£ ņĀäļ¼Ė ņØĖļĀźņØ┤ ĒĢäņÜöĒĢśĻ│Ā ņןļ╣äĻ░Ć Ļ│ĀĻ░ĆņØ┤ĻĖ░ļĢīļ¼ĖņŚÉ Ļ░£ļ░£ļÅäņāüĻĄŁņŚÉņä£ļŖö ņØ┤ņÜ®ĒĢśĻĖ░ ņ¢┤ļĀĄļŗż. ļ│Ė ņŚ░ĻĄ¼Ļ▓░Ļ│╝ļĪ£ ļ¦łņØ┤Ēü¼ļĪ£ ņŚ¼Ļ│╝ĻĖ░ļź╝ ĒåĄĒĢ┤ ņåīļ¤ēņØĖ 5 ŃÄĢ ĒśłņĢĪņ£╝ļĪ£ļČĆĒä░ ļ░▒ĒśłĻĄ¼ļź╝ ĒżĒÜŹĒĢśĻ│Ā ĒżĒÜŹļÉ£ ņäĖĒżņŚÉņä£ CD4+ T ņäĖĒż ļ░Å CD8+ T ņäĖĒżļź╝ ļČäņäØĒĢśņŚ¼ AIDSļź╝ Ļ▓Ćņé¼ĒĢśļŖö ņןļ╣äļź╝ Ļ░£ļ░£ĒĢśņśĆļŗż. Ēśäņ×¼ņØś Ļ▓Ćņé¼ ņןļ╣äļ│┤ļŗż ņĀĆļĀ┤ĒĢśĻ│Ā Ļ│ĀļÅäņØś ĻĖ░ņłĀņØ┤ ĒĢäņÜöĒĢśņ¦Ć ņĢŖņ£╝ļ®░ Ē£┤ļīĆĻ░Ć Ļ░äĒÄĖĒĢ£ ĒÜŹĻĖ░ņĀüņØĖ A IDS Ļ▓Ćņé¼ ņןļ╣äņ×äņØä ņŗ£ņé¼ĒĢ£ļŗż.
It is estimated that there are 40 million people with AIDS worldwide, with most cases occurring mainly in developing countries. HIV, the virus that causes AIDS, is infected with CD4+ T cells in the blood and gradually destroys CD4+ T cells for several months to 10 years, thereby lowering the patient's immune function. AIDS patients who have weakened immunity in this way will die from various diseases. The current method for counting the number of CD4+ T cells is usually performed by flow cytometry. The flow cytometry method has the advantage of high accuracy, but it is difficult to use in developing countries because it requires skilled professionals and equipment is expensive. As a result of this study, a device for AIDS screening was developed by capturing leukocytes from a small amount of 5 ŃÄĢ blood through a microfilter and analyzing CD4+ T cells and CD8+ T cells from the captured cells. cheaper and easier to carry and use than current test equipment.
AIDS ĒÖśņ×ÉļŖö ņĀä ņäĖĻ│äņŚÉ 3,700ļ¦ī ļ¬ģņØĖ Ļ▓āņ£╝ļĪ£ ņČöņé░ļÉśļ®░, ņŻ╝ļĪ£ Ļ░£ļ░£ļÅäņāüĻĄŁņŚÉņä£ ļīĆļČĆļČäņØś ĒÖśņ×ÉĻ░Ć ļ░£ņāØĒĢśĻ│Ā ņ׳ļŗż(Geneva, 2016). AIDSņØś ņøÉņØĖ ļ░öņØ┤ļ¤¼ņŖżņØĖ HIVļŖö ļ░▒ĒśłĻĄ¼ ņżæ CD4+ T ņäĖĒżļź╝ Ļ░ÉņŚ╝ņŗ£ņ╝£ ņłśĻ░£ņøö ļé┤ņ¦Ć 10ļģä Ļ░äņØś ņ×Āļ│ĄĻĖ░Ļ░äņØä Ļ▒░ņ╣śļ®░ CD4+ T ņäĖĒżļź╝ 200 ņäĖĒż/ŃÄĢ ļ»Ėļ¦īņ£╝ļĪ£ ļ¢©ņ¢┤ļ£©ļĀż ĒÖśņ×ÉņØś ļ®┤ņŚŁĻĖ░ļŖźņØä ņĀĆĒĢśņŗ£Ēé©ļŗż(Phillips, 2001; Phillips, 2003; Antinori, 2011). ļ®┤ņŚŁļĀźņØ┤ ņĢĮĒÖöļÉ£ ĒÖśņ×ÉļŖö ļŗżņ¢æĒĢ£ ļ│æņ”ØņŚÉ ņØśĒĢ┤ ņé¼ļ¦ØņŚÉ ņØ┤ļź┤Ļ▓ī ļÉ£ļŗż.
AIDS ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ņ¦Ć ņŚ¼ļČĆļź╝ ĒīÉņĀĢĒĢśĻĖ░ ņ£äĒĢ┤ Ēśłņżæ CD4+ T ņäĖĒżļź╝ Ļ│äņĖĪĒĢśļŖö ļ░®ļ▓ĢņØ┤ ņ׳ļŗż(de Wolf, 1988; Andrew, 2006). ņØ┤ņÖĆ Ļ░ÖņØĆ Ļ│äņĖĪ ļ░®ļ▓ĢņŚÉļŖö CD4+ T ņäĖĒżņØś ņĀłļīĆņłśļź╝ ņ╣┤ņÜ┤ĒŖĖĒĢśļŖö ļ░®ļ▓ĢĻ│╝, ņĀäņ▓┤ ļ”╝ĒöäĻĄ¼ ņłś ņżæņŚÉ CD4+ T ņäĖĒż ņłśĻ░Ć ņ░©ņ¦ĆĒĢśļŖö ļ╣äņ£©ņØä ņé░ņČ£ĒĢśļŖö ļ░®ļ▓Ģ(CD4/ļ”╝ĒöäĻĄ¼), CD8+ T ņäĖĒż ņłśņŚÉ ļīĆĒĢ£ CD4+ T ņäĖĒż ņłśņØś ļ╣äņ£©ņØä ņé░ņČ£ĒĢśļŖö ļ░®ļ▓Ģ(CD4/CD8)ņØ┤ ņ׳ļŗż(Sauter, 2016). CD4/ļ”╝ĒöäĻĄ¼ņÖĆ CD4/CD8ļŖö ļéśņØ┤ņŚÉ ņāüĻ┤ĆņŚåņØ┤ ĻĘĖ Ļ░ÆņØś ļ│ĆļÅÖņØ┤ ļ╣äĻĄÉņĀü ņĀüĻĖ░ļĢīļ¼ĖņŚÉ CD4/ļ”╝ĒöäĻĄ¼ņÖĆ CD4/CD8 ļ╣äņ£©ņØä ņé░ņČ£ĒĢśļŖö ļ░®ļ▓ĢņØ┤ ņŻ╝ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż(Sauter, 2016). WHO Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ļŖö CD4+ T ņäĖĒżņłśĻ░Ć 350 ņäĖĒż/ŃÄĢ ņØ┤ĒĢśņØ┤Ļ▒░ļéś, 5ņäĖ ļ»Ėļ¦īņØś ņ£ĀņĢäņØś Ļ▓ĮņÜ░ CD4/ļ”╝ĒöäĻĄ¼Ļ░Ć 0.25 ņØ┤ĒĢśņØĖ Ļ▓ĮņÜ░, CD4/CD8ņØ┤ 1 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ AIDS ņ╣śļŻīļź╝ Ļ░£ņŗ£ĒĢśļŖö ņŗ£ņĀÉņ£╝ļĪ£ ļ│┤Ļ│Ā ņ׳ļŗż(Geneva, 2016).
Ēśäņ×¼, CD4+ T ņäĖĒż ņłśļź╝ Ļ│äņĖĪĒĢśļŖö ļ░®ļ▓ĢņØĆ ĒåĄņāü ņ£ĀņäĖĒżļČäņäØ(flow cytometry) ļ░®ļ▓ĢņŚÉ ņØśĒĢ┤ ņŗ£Ē¢ēļÉśĻ│Ā ņ׳ļŗż(de Wolf, 1988) (Figure 1). ņØ┤ Ļ▓Ćņé¼ļ▓ĢņØĆ ņĀĢĒÖĢļÅäĻ░Ć ļåÆļŗżļŖö ņןņĀÉņØ┤ ņ׳ņ£╝ļéś Ļ│ĀĻ░ĆņØś ņןļ╣äļĪ£ ņłÖļĀ©ļÉ£ ņĀäļ¼Ė ņØĖļ¤Ł ļō▒ ņČ®ļČäĒĢ£ ņØĖĒöäļØ╝Ļ░Ć ĻĄ¼ņČĢļÉ£ ņäĀņ¦äĻĄŁ ņ£äņŻ╝ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā Ļ░£ļ░£ļÅäņāüĻĄŁņŚÉņä£ļŖö ņØ┤ņÜ®ĒĢśĻĖ░ ņ¢┤ļĀżņÜ░ļ®░, ļ¬ć Ļ░Ćņ¦Ć ļŗ©ņĀÉļōżņØ┤ ņ׳ļŗż: 1) ļŗżņåī ļ¦ÄņØĆ 100 ŃÄĢ ņØś ĒśłņĢĪņØ┤ ĒĢäņÜöĒĢśļŗż. 2) ņĀäļ¼Ė ņØĖļĀźņØś ņłÖļĀ©ļÅäņŚÉ ļö░ļØ╝ ļŗżļź┤ņ¦Ćļ¦ī ļŗżņåī ļ¦ÄņØĆ ņŗ£Ļ░ä(20ļČä ņØ┤ņāü)ņØ┤ ĒĢäņÜöĒĢśļŗż. 3) Ļ│ĀĻ░ĆņØś ņןļ╣ä(75,000~100,000 USD)ļĪ£ ņØĖĒĢśņŚ¼ Ļ▓Ćņé¼ļ╣äĻ░Ć Ļ│ĀĻ░ĆņØ┤ļŗż. 4) Ļ▓Ćņé¼ Ļ▓░Ļ│╝ Ļ░ÆņØä CD4 ņłśņ╣śņÖĆ CD4 ļ╣äņ£©(CD4/ļ”╝ĒöäĻĄ¼)ļ¦ī ņĀ£Ļ│ĄĒĢ£ļŗż.
ņĢäņ¦üĻ╣īņ¦ĆļÅä ĻĖ░ņĪ┤ ņ£ĀņäĖĒżļČäņäØ Ļ▓Ćņé¼ļ▓ĢņØ┤ CD Ļ▓Ćņé¼ ņŗ£ņןņŚÉņä£ 70%ņØś ņĀÉņ£Āņ£©ņØä ņ░©ņ¦ĆĒĢśĻ│Ā ņ׳ļŗż. Ēśäņ×¼ 4Ļ░£ ĒÜīņé¼ņŚÉņä£ Ē£┤ļīĆņÜ® CD4 Ļ▓Ćņé¼ņןļ╣äĻ░Ć ļéśņÖĆ ņ׳ņ¦Ćļ¦ī ņŗ£ņןņŚÉ ļéśņÖĆ ņ׳ļŖö POC(Point of Care) CD4 ņןļ╣äļŖö ļīĆļČĆļČä ĻĖ░ņĪ┤ Cytometry ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ĒśłņĢĪņØ┤ 10 ŃÄĢ ņØ┤ņāü ĒĢäņÜöĒĢśĻ│Ā Ļ▓Ćņé¼ņŚÉ ņåīņÜöļÉśļŖö ņŗ£Ļ░äņØ┤ 20ļČä ņØ┤ņāüņØ┤ļ®░ 1 ņØ╝ 20Ļ▒┤ņØś Ļ▓Ćņé¼ļ░¢ņŚÉļŖö ņłśĒ¢ēĒĢĀ ņłś ņŚåļŖö ļ¼ĖņĀ£ņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż.
Ļ▓īļŗżĻ░Ć, ĻĖ░ņĪ┤ CD4 Ļ▓Ćņé¼ ņןļ╣äļōżņØ┤ ņĀ£Ļ│ĄĒĢśļŖö Ļ▓Ćņé¼Ļ▓░Ļ│╝ļŖö CD4 ņłśņ╣śņÖĆ CD4 ļ╣äņ£©ļ¦ī ņĀ£Ļ│ĄĒĢśĻ│Ā ņ׳ļŖöļŹ░ ņØ┤ļŖö WHO Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØä ņČ®ņĪ▒ņŗ£Ēéżņ¦Ć ļ¬╗ĒĢśļŖö Ļ▓░Ļ│╝ņØ┤ļŗż.
ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ĒīĆņŚÉņä£ HIV ĒÖśņ×É 3,700ļ¦īļ¬ģ ņżæ 80%Ļ░Ć ļČäĒżļÉśņ¢┤ ņ׳ļŖö ņĀĆņåīļōØ ĻĄŁĻ░Ćļź╝ ņ£äĒĢ£ WHO Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉ ļČĆĒĢ®ĒĢśļŖö ņ¦Ćļ”ä 3 ŃÄøņØś ņŚ¼Ļ│╝ĻĖ░ļź╝ ĒåĄĒĢ┤ 5 ŃÄĢņØś ņåīļ¤ēņØś ĒśłņĢĪņØä ņØ┤ņÜ®ĒĢśņŚ¼ 95%ņØś ļ░▒ĒśłĻĄ¼ļź╝ ņäĀļ│äĒĢśņŚ¼ 10ļČä ņØ┤ļé┤ņŚÉ Ļ▓Ćņé¼ĒĢĀ ņłś ņ׳ļŖö ņ▓┤ņÖĖņ¦äļŗ©ņÜ® Ē£┤ļīĆņÜ® Ļ▓Ćņé¼ņןļ╣äļź╝ ņĀ£ņŗ£ĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ļ│Ė Ļ░£ļ░£ļÉ£ ņŗ£ņŖżĒģ£ņØĆ Ļ░Ćņן ņĀüņØĆ ņÜ®ļ¤ēņØĖ ĒśłņĢĪ 5 ŃÄĢļź╝ ĒĢĄņŗ¼ ĻĖ░ņłĀņØĖ 3 ŃÄøņØś ļ¦łņØ┤Ēü¼ļĪ£ ņŚ¼Ļ│╝ĻĖ░ļź╝ ĒÖ£ņÜ®ĒĢśņŚ¼ 95%ņØś ļ░▒ĒśłĻĄ¼ļź╝ ņäĀļ│äĒĢĀ ņłś ņ׳ņ¢┤ 10ļČä ņØ┤ļé┤ņŚÉ CD4 Ļ▓Ćņé¼Ļ░Ć Ļ░ĆļŖźĒĢśļŗż(Figure 2).
WHO Ļ░ĆņØ┤ļō£ ļØ╝ņØĖņŚÉņä£ ņÜöĻĄ¼ĒĢśļŖö CD4 ņłśņ╣ś, CD4 ļ╣äņ£© ļ░Å CD4/CD8 ļ╣äņ£©Ļ╣īņ¦ĆļÅä ņŗ£ ņŖżĒģ£ĒÖöĒĢśņŚ¼ Ļ▓Ćņé¼Ļ▓░Ļ│╝ļź╝ ņĀ£Ļ│ĄĒĢĀ ņłś ņ׳ļŗż. ļśÉĒĢ£ ĻĄŁļé┤ ņÜ░ņłśĒĢ£ IT ĻĖ░ņłĀņØä ņ£ĄĒĢ®ĒĢśņŚ¼ Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļź╝ ņżæņĢÖ Ļ┤Ćļ”¼ ĻĖ░Ļ┤ĆņŚÉ ņĀĆņןĒĢśņŚ¼ Ļ┤Ćļ”¼ĒĢĀ ņłś ņ׳ļÅäļĪØ ĒĢśņŚ¼ WHOņŚÉņä£ HIV Ļ░ÉņŚ╝ Ļ┤Ćļ”¼ ļ░Å ĻĖ░ņ┤ł ņĪ░ņé¼ ņŚ░ĻĄ¼ņŚÉ big dataļĪ£ņä£ ĒÖ£ņÜ®ĒĢĀ ņłś ņ׳ļÅäļĪØ Ļ░£ļ░£ ņżæņØ┤ļŗż.
ļ│Ė Ļ░£ļ░£ ņżæņØĖ ņŗ£ņŖżĒģ£ņØĆ ĻĖ░ņĪ┤ ĒĢ┤ņÖĖ ņŚģņ▓┤ļōżĻ│╝ņØś Ļ▓Įņ¤üļĀźņŚÉņä£ ņ░©ļ│äĒÖö ĒĢĀ ņłś ņ׳ļŖö ņןņĀÉļōżņØä ļ│┤ņ£ĀĒĢśĻ│Ā ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ļ╣ĀļźĖ ņŗ£ņן ņĀÉņ£Āļź╝ ņ£äĒĢ┤ņä£ļØ╝ļÅä ņŗ£ĻĖēĒĢ£ Ļ░£ļ░£ ņ¦ĆņøÉņØ┤ ĒĢäņÜöĒĢ£ ņāüĒÖ®ņØ┤ļŗż.
FITCĻ░Ć Ļ▓░ĒĢ®ļÉ£ CD4 ļ░Å PEĻ░Ć Ļ▓░ĒĢ®ļÉ£ CD8 ĒĢŁņ▓┤ļōżņØĆ Southern Biotechņé¼(ļ»ĖĻĄŁ)ņŚÉņä£ ĻĄ¼ņ×ģĒĢśņŚ¼ ņé¼ņÜ®ĒĢśņśĆļŗż. Dimethyl sulfoxide (DMSO), 0.5% trypsin-ethylenediaminetetraacetic acid (EDTA) solution (10├Ś) ļ░Å phosphate buffered saline (PBS, pH 7.4) ņŗ£ņĢĮļōżņØĆ Sigmaņé¼(ļ»ĖĻĄŁ)ļĪ£ļČĆĒä░ ĻĄ¼ņ×ģĒĢśņśĆļŗż. Ļ│ĀņĀĢņĢĪ ļ░Å ņ£ĀņäĖĒż ļČäņäØ ņŗ£ņĢĮņØĆ Beckman Coulterņé¼(ļ»ĖĻĄŁ)ņŚÉņä£ ĻĄ¼ņ×ģĒĢśņśĆļŗż.
ĒśłņĢĪ ņāśĒöī 5 ŃÄĢņØä CD ĒĢŁņøÉņØä Ēæ£ņĀüņ£╝ļĪ£ ĒĢśļŖö ĒśĢĻ┤æ Ēæ£ņ¦ĆļÉ£ ĒĢŁņ▓┤ļź╝ ĒżĒĢ©ĒĢśļŖö ņäĖĒż ņŚ╝ņāē ņÜ®ņĢĪĻ│╝ Ēś╝ĒĢ®ĒĢśņśĆļŗż. ĒśłņĢĪ ņāśĒöīņØä RBC ņÜ®ĒĢ┤ ņÜ®ņĢĪĻ│╝ Ēś╝ĒĢ®ĒĢśĻ│Ā ņŗżņś©ņŚÉņä£ 1ļČä ļÅÖņĢł ļ░śņØæņŗ£Ēé© Ēøä ņżæĒÖö ņÜ®ņĢĪņØä ņ▓©Ļ░ĆĒĢśņśĆļŗż. ĻĘĖļ¤░ ļŗżņØī, ņĄ£ņóģ ļČĆĒö╝Ļ░Ć 1 ŃÄ¢ņØ┤ ļÉśļÅäļĪØ ļ¦×ņČöĻ│Ā 20ļČä ļÅÖņĢł ļ░śņØæĒĢśņśĆļŗż. GBTsol ICAņŚÉ ņāśĒöī ņŻ╝ņ×ģ Ēøä ĒöäļĪ£ĻĘĖļש ļČäņäØņØä ņŗ£ņ×æĒĢśņŚ¼ Ļ▓░Ļ│╝ļź╝ ņ¢╗ņŚłļŗż.
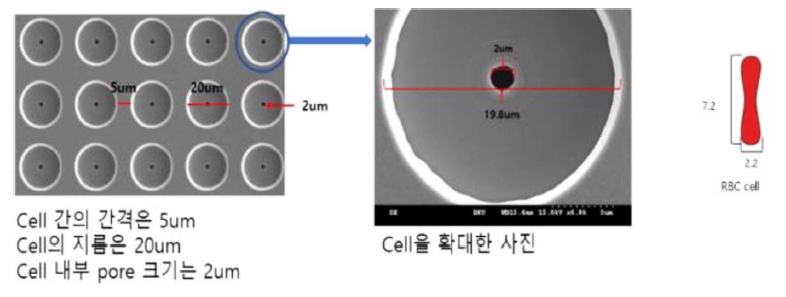
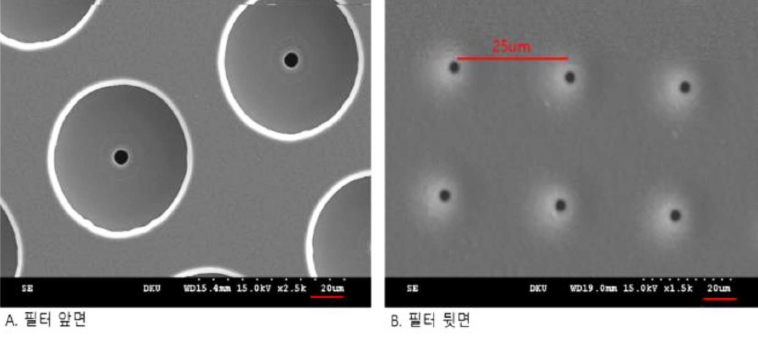
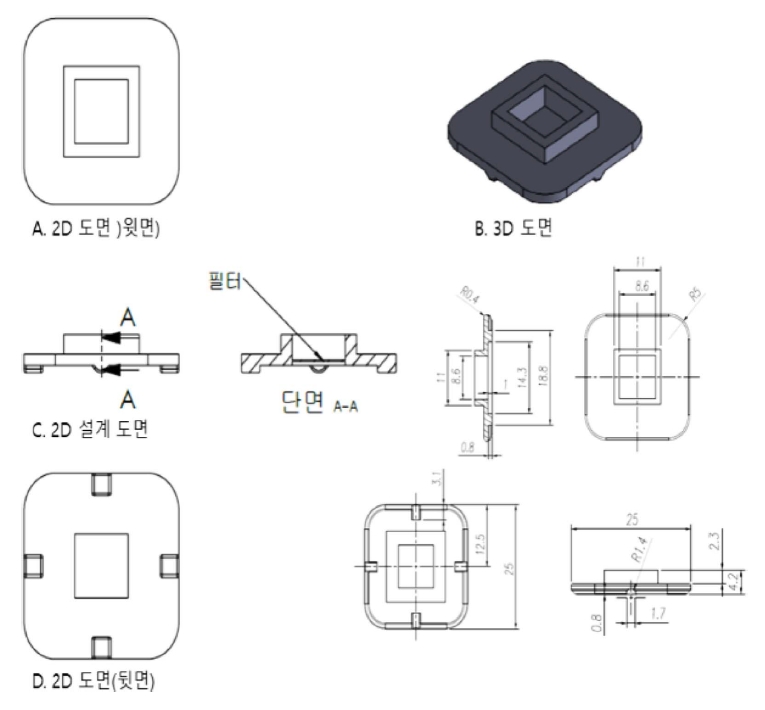
ļ¦łņØ┤Ēü¼ļĪ£ ņŚ¼Ļ│╝ĻĖ░ļŖö ļŗłņ╝ł ņĀ£ņ¦łļĪ£ ĒĢäĒä░ņØś Ēü¼ĻĖ░ļŖö 144 mm, ĻĄ¼ļ®ŹņØś ņłśļŖö 100,000Ļ░£ļĪ£ ĻĄ¼ļ®Ź Ēü¼ĻĖ░ ļ░Å Ļ░äĻ▓®ņØĆ Ļ░üĻ░ü 2.0~5.0 ŃÄøņÖĆ 20~25 ŃÄøņØ┤ļŗż(Figure 3~5).
ļ│Ė ņŚ░ĻĄ¼Ļ▓░Ļ│╝ļĪ£ ļŗłņ╝ł ņ×¼ņ¦łņØś ļ¦łņØ┤Ēü¼ļĪ£ ņŚ¼Ļ│╝ĻĖ░Ļ░Ć ņןļ╣ä Ļ░£ļ░£ņŚÉ ņĀüĒĢ®ĒĢśļŗżĻ│Ā ĒīÉļŗ©ĒĢśņśĆņ£╝ļéś, ņŗżņĀ£ ņĄ£ņóģ ņ¢æņé░ ļŗ©Ļ│äņŚÉņä£ļŖö ļ¬ć Ļ░Ćņ¦Ć ĒĢ┤Ļ▓░ĒĢ┤ņĢ╝ ĒĢĀ ņé¼ĒĢŁļōżņØ┤ ņ׳ņŚłļŗż. ņ▓½ļ▓łņ¦ĖļĪ£ ļŗłņ╝ł ļ¦łņØ┤Ēü¼ļĪ£ ņŚ¼Ļ│╝ĻĖ░ņØś ļŗ©Ļ░ĆĻ░Ć ļåÆņØĆ ĒÄĖņØ┤ļ®░, ļæÉļ▓łņ¦ĖļĪ£ ĻĖłņåŹņØĖ ļŗłņ╝ł ņ×¼ņ¦łļĪ£ ņØĖĒĢśņŚ¼ Ļ┤æņøÉņŚÉ ļīĆĒĢ£ ļ¦łņØ┤Ēü¼ļĪ£ ņŚ¼Ļ│╝ĻĖ░ņØś ļ╣ø ļ░śņé¼ņŚÉ ļö░ļźĖ ĒśĢĻ┤æ ļČäņäØņŚÉ ņóŗņ¦Ć ņĢŖņØĆ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŗżĻ│Ā ĒīÉļŗ©ļÉśņŚłļŗż.
ļö░ļØ╝ņä£, ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ņä£ ņ¦ĆĻĖłņØś ņ¢æņé░ ņĀ£ĒÆłņŚÉļŖö ĻĖłņåŹņØĖ ļŗłņ╝ł ņ×¼ņ¦łņØś ļ¦łņØ┤Ēü¼ļĪ£ ņŚ¼Ļ│╝ĻĖ░ņŚÉ ļīĆĒĢ£ ļŗ©ņĀÉņØ┤ ļ│┤ņÖäļÉ£ polyester(PET) ņ×¼ņ¦łņØś ļ¦łņØ┤Ēü¼ļĪ£ ņŚ¼Ļ│╝ĻĖ░ļź╝ ĒÖ£ņÜ®ĒĢśĻ│Ā ņ׳ļŗż.
ĒØĪņ×ģļČĆņÖĆ ņŚ░Ļ▓░ ļ░Å ļČäņäØ ņÖäļŻī Ēøä ĻĖ░ĻĖ░ļĪ£ļČĆĒä░ ņĀ£Ļ▒░Ļ░Ć ņÜ®ņØ┤ĒĢśļÅäļĪØ ņäżĻ│äĒĢśņśĆļŗż(Figure 6). ļśÉĒĢ£ ņ¦äĻ│Ą, ņĢĢļĀź ļō▒ņŚÉ ņØśĒĢ£ Ē£śņ¢┤ņ¦ĆĻ│Ā ļłäņłśļÉśļŖö ļ¼ĖņĀ£ņĀÉņØ┤ ļ░£ņāØĒĢśņ¦Ć ņĢŖļÅäļĪØ ņäżĻ│äļÉśņŚłļŗż.
Ļ┤æĒĢÖ ņןļ╣äļŖö 3Ļ░Ćņ¦Ć ĒśĢĻ┤æņØä ļČäņäØĒĢśļŖöļŹ░ ņĀüĒĢ®ĒĢśļÅäļĪØ ņäżĻ│äĒĢśņśĆļŗż(Table 1).
GBTsol ICA ļČäņäØ ņåīĒöäĒŖĖņø©ņ¢┤ļŖö CMOS ņ╣┤ļ®öļØ╝ļź╝ ĒåĄĒĢ┤ ņ┤¼ņśüļÉ£ ņØ┤ļ»Ėņ¦Ćļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ RGB Ļ░ÆņØä ĒÜŹļōØĒĢśĻ│Ā ņØ┤ Ļ░ÆņØä 3ņ░©ņøÉ ĻĘĖļלĒöäļĪ£ Ēæ£ņŗ£ĒĢśņŚ¼ Ļ░£ļ░£ņ×ÉĻ░Ć ņĀĢļÅä Ļ┤Ćļ”¼ļź╝ ĒĢĀ ņłś ņ׳Ļ▓ī ņĀ£ņ×æĒĢśņśĆļŗż(Figure 9). ļśÉĒĢ£, ņØ┤ 3ņ░©ņøÉ ĻĘĖļלĒöä Ļ░ÆņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņäĖĒżņØś Ļ░£ņłśļź╝ GBTsol ICAņŚÉ ņ¦üņĀæ ņł½ņ×ÉļĪ£ Ēæ£ņŗ£ĒĢśĻ▒░ļéś ņĀĢļÅä Ļ┤Ćļ”¼ ĒöäļĪ£ĻĘĖļשņŚÉņä£ ņØ┤ļ»Ėņ¦Ć ĒīīņØ╝Ļ│╝ ņäĖĒżņØś ņł½ņ×ÉļĪ£ Ēæ£ņŗ£ĒĢĀ ņłś ņ׳Ļ▓ī Ļ░£ļ░£ĒĢśņśĆļŗż(Figure 10). Ļ░£ļ░£ļÉ£ ņןļ╣äņŚÉ ņØśĒĢ┤ CD4 ļ░Å CD8 ļČäņäØ Ļ░ĆļŖźĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż.
ņåīļ¤ēņØś ĒśłņĢĪņ£╝ļĪ£ ļ░▒ĒśłĻĄ¼ļź╝ ļČäļ”¼ĒĢśļŖö ļ¦łņØ┤Ēü¼ļĪ£ ņŚ¼Ļ│╝ĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ AIDS ņ╣śļŻī Ļ░£ņŗ£ņØś ĒīÉņĀĢ ļ░Å AIDS ņ╣śļŻī Ļ│╝ņĀĢņØś ĒÜ©Ļ│╝ņĀüņØĖ ļ¬©ļŗłĒä░ļ¦üņØ┤ Ļ░ĆļŖźĒĢ£ ļČäņäØ ĻĖ░ĻĖ░ ņŚ░ĻĄ¼ĒĢśļŖö Ļ│╝ņĀĢņŚÉņä£ Ļ░£ļ░£ļÉ£ ĒśłņĢĪņØś ļ░▒ĒśłĻĄ¼ ņżæ CD4(ņäĖĒżĒæ£ļ®┤ĒĢŁņøÉļ¼┤ļ”¼ 4) ļ░Å CD8(ņäĖĒżĒæ£ļ®┤ĒĢŁņøÉļ¼┤ļ”¼ 8)Ļ░Ć ļ░£ĒśäļÉ£ ņäĖĒżļź╝ ņ¦üņĀæ ļ®┤ņŚŁĒśĢĻ┤æļ▓ĢņØä ņØ┤ņÜ®ĒĢ┤ ņŚ╝ņāēĒĢ£ Ēøä ĻĘĖ ņłśļź╝ ņĖĪņĀĢ(Ļ│äņłś)ĒĢśņŚ¼ ĒśłņĢĪņ¦łĒÖś ņ¦äļŗ© ļ│┤ņĪ░ņŚÉ ļÅäņøĆņØä ņŻ╝ļŖö ņ▓┤ņÖĖņ¦äļŗ©ņÜ® ņŗ£ņĢĮņØä ņłśņČ£ĒŚłĻ░Ć ĒÜŹļōØĒĢśņśĆļŗż(ņĀ£19-4927ĒśĖ, ņĀ£19-4926ĒśĖ). Ļ▓īļŗżĻ░Ć GBTsol ICA ņןļ╣äļŖö CE ņØĖņ”ØņØä ĒÜŹļōØĒĢśņśĆņ£╝ļ®░, ņĢäĒöäļ”¼ņ╣┤, ļČüļ»Ė ļō▒ ņŚ¼ļ¤¼ ĻĄŁĻ░ĆņÖĆ ņłśņČ£ ļģ╝ņØś ņżæņŚÉ ņ׳ļŗż(DE/CA29/108131/D028).
ļ│Ė ņŚ░ĻĄ¼ļĪ£ ņĘ©ļōØĒĢ£ ĒŖ╣ĒŚłļŖö Ēśäņ×¼Ļ╣īņ¦Ć ņ┤Ø 4Ļ▒┤ņØ┤ ņČ£ņøÉ ļ░Å ļō▒ļĪØĒĢśņśĆņ£╝ļ®░, Ļ▓Ćņé¼ ņןņ╣ś ļ░Å ņ¦äļŗ© ļ░®ļ▓Ģņ£╝ļĪ£ ņäĖļČäĒÖöļÉśņŚłļŗż(2021ļģä 9ņøö ĻĖ░ņżĆ).
Ļ░£ļ░£ļÉ£ ļ│Ė ļ®┤ņŚŁĒśĢĻ┤æņĖĪņĀĢĻĖ░ļŖö ĒśłņĢĪ ļé┤ ļ░▒ĒśłĻĄ¼ņØś Ēæ£ļ®┤ņŚÉ ņ׳ļŖö CD4, CD8 ļō▒ņØ┤ ļ░£ĒśäļÉ£ ļ®┤ņŚŁ ņäĖĒżņØś ņł½ņ×Éļź╝ ņĀĢļ░ĆĒĢśĻ▓ī Ļ│äņĖĪĒĢśļŖö ĻĖ░ļŖźņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż.
ņ”ē, ĒŖ╣ņĀĢ ņäĖĒżļōżņØś ņłśņ╣śļĪ£ ņ¦łļ│æņØä ņ¦äļŗ©ĒĢśļŖöļŹ░ ņØ┤ņÜ®ļÉĀ ņłś ņ׳ļŗż. ņĢäņÜĖļ¤¼ ņĀäņ▓śļ”¼ ļŗ©Ļ│äĻ░Ć ļŗ©ņł£ĒĢśļ®░ Ļ▓Ćņé¼ ņåīņÜöņŗ£Ļ░äņØ┤ ņĢĮ 20ļČä ļé┤ļĪ£ ņ¦¦ņ£╝ļ®░ Ē£┤ļīĆņŚÉ ņÜ®ņØ┤ĒĢ£ Ēü¼ĻĖ░ļĪ£ Ļ░£ļ░£ļÉśņ¢┤ Ē£┤ļīĆĻ░Ć Ļ░äĒÄĖĒĢśņŚ¼ ņ¢┤ļŖÉ Ļ││ņŚÉņä£ļéś Ļ▓Ćņé¼Ļ░Ć Ļ░ĆļŖźĒĢśļŗż. ņČ®ņĀä ļ░®ņŗØ ņĀäņøÉņØä ņ▒äĒāØĒĢśņŚ¼ ņĀäĻĖ░Ļ░Ć Ļ│ĄĻĖēļÉśņ¦Ć ņĢŖņØĆ Ļ││ņŚÉņä£ļÅä ņé¼ņÜ® Ļ░ĆļŖźĒĢśļŗżļŖö ņןņĀÉņØ┤ ņ׳ļŗż.
ļ│Ė ņŚ░ĻĄ¼ļĪ£ Ļ░£ļ░£ļÉ£ GBTsol ICAļŖö ĻĖ░ņĪ┤ ņ£ĀņäĖĒżļČäņäØĻĖ░ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ļČäņäØĻ▓░Ļ│╝ ņØ┤ļ»Ėņ¦ĆĻ░Ć ņÖĖņן USB ļ®öļ¬©ļ”¼ ņ╣®ņŚÉ ņĀĆņןļÉśļ®░ 4Ļ░£ ņØ┤ņāüņØś ĒśĢĻ┤æņØä ļČäņäØĒĢĀ ņłś ņŚåļŗżļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż. ĻĘĖļ¤╝ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, ļ¦łņØ┤Ēü¼ļĪ£ ņŚ¼Ļ│╝ĻĖ░ļź╝ ĒåĄĒĢ┤ ĒśłņĢĪņ£╝ļĪ£ļČĆĒä░ ļ░▒ĒśłĻĄ¼ļź╝ ĒżĒÜŹĒĢśĻ│Ā ĒżĒÜŹļÉ£ ņäĖĒżņŚÉņä£ CD4+ T ņäĖĒż, CD8+ T ņäĖĒż ļō▒ņØä ļČäņäØĒĢśņŚ¼ AIDS ņ╣śļŻī Ļ░£ņŗ£ ņŗ£ĻĖ░ ļ░Å AIDS ņ╣śļŻī Ļ│╝ņĀĢņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ļ¬©ļŗłĒä░ļ¦üņØ┤ Ļ░ĆļŖźĒĢ£ ĻĖ░ņĪ┤ ņןļ╣äļ│┤ļŗż Ē¢źņāüļÉ£ ņĀĢĒÖĢļÅä, ņĀĆļĀ┤ĒĢ£ Ļ░ĆĻ▓®, ļŗ©ņł£ĒĢ£ ņĀäņ▓śļ”¼ ļŗ©Ļ│ä, Ļ│ĀļÅäņØś ĻĖ░ņłĀ ĒĢäņÜöņŚåņØ┤ Ļ░äĒÄĖĒĢśĻ▓ī ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŖö ĒÄĖļ”¼ņä▒ ļ░Å ņ×æņØĆ Ēü¼ĻĖ░ļĪ£ ņØ┤ļÅÖĻ│╝ Ē£┤ļīĆĻ░Ć ņē¼ņÜ┤ ņןņĀÉņØ┤ ņ׳ļŗż.
ņÜ░ļ”¼ļŖö ļ│Ė ņŚ░ĻĄ¼ ĒåĄĒĢ┤ ņåīļ¤ēņØś ĒśłņĢĪņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ Ļ░äĒÄĖĒĢśĻ│Ā ĒÄĖļ”¼ĒĢśĻ▓ī AIDSļź╝ Ļ▓Ćņé¼ĒĢĀ ņłś ņ׳ļŖö ņןļ╣äļź╝ Ļ░£ļ░£ĒĢśņśĆļŗż. ļŹöļČłņ¢┤, ļ®┤ņŚŁ ņäĖĒż ņ╣śļŻīļź╝ ļ░øņØĆ ĒÖśņ×ÉņØś ļ®┤ņŚŁ ņäĖĒż ļ¬©ļŗłĒä░ļ¦ü, ņĪ░Ēśłļ¬©ņäĖĒż ņØ┤ņŗØ Ēøä ļ®┤ņŚŁĻ│äņØś ļ¬©ļŗłĒä░ļ¦ü ļō▒ ļ®┤ņŚŁ ņäĖĒżļź╝ ņØ┤ņÜ®ĒĢ£ ļŗżņ¢æĒĢ£ ļ¬©ļŗłĒä░ļ¦ü ļ░Å ņ¦äļŗ© Ļ▓Ćņé¼ ļō▒ņŚÉ ņĀüņÜ®ņØ┤ Ļ░ĆļŖźĒĢĀ Ļ▓āņ×äņØä ņŗ£ņé¼ĒĢ£ļŗż.
Figure┬Ā5.
Ļ░ü ĻĄ¼ļ®ŹņŚÉ ļ░▒ĒśłĻĄ¼ Ēżņ¦æ ĒÖĢņØĖĒĢ£ ņĀäņ×ÉĒśäļ»ĖĻ▓Į ņØ┤ļ»Ėņ¦Ć. ĒĢ┤ņāüļÅä 25 ŃÄø (A)ņÖĆ 100 ŃÄø (B)

Figure┬Ā10.
GBTsol ICAņØä ņØ┤ņÜ®ĒĢ£ CD4+ T ņäĖĒż((2), ļģ╣ņāē)ņÖĆ CD8+ T ņäĖĒż((1), ļģĖļ×Ćņāē) ļČäņäØ ņØ┤ļ»Ėņ¦Ć

Table┬Ā1.
CMOS ņ╣┤ļ®öļØ╝ ņäĖļČĆ ņé¼ĒĢŁ ļ╣äĻĄÉ
References
Antinori, A. (2011) Late presentation of HIV infection: a consensus definition, HIV Medicine, 12(1), pp. 61-64.
de Wolf, (1988). Numbers of CD4+ cells and the levels of core antigens of and antibodies to the human immunodeficiency virus as predictors of AIDS among seropositive homosexual men. The Journal of Infectious Diseases, 158(3), pp. 615-622.


Geneva. (2016) World Health Organization. Consolidated Guidelines on the Use of Antiretroviral Drugs for Treating and Preventing HIV Infection: Recommendations for a Public Health Approach.
Phillips, A. N. (2001). HIV viral load response to antiretroviral therapy according to the baseline CD4 cell count and viral load. JAMA, 286(20), pp. 2560-2567.


Phillips, A. N. (2003). When should antiretroviral therapy be started for HIV infection? Interpreting the evidence from observational studies. AIDS, 17(13), pp. 1863-1869.


- TOOLS








 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print