ņä£ļĪĀ
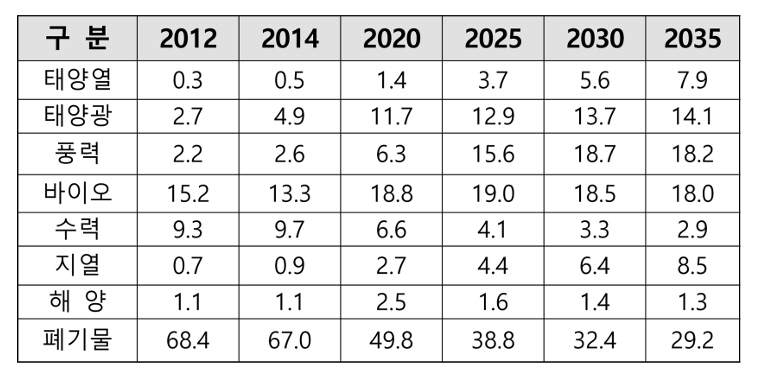
ņĄ£ĻĘ╝ ņØ┤ņŖłĒÖöĒĢśĻ│Ā ņ׳ļŖö ĒÅÉĒöīļØ╝ņŖżĒŗ▒ ļō▒ ĒÖśĻ▓Įļ¼ĖņĀ£ļź╝ ņ£Āļ░£ĒĢśļŖö ņ▓śļ”¼ļ░®ļ▓Ģņ£╝ļĪ£ ņŚ┤ļČäĒĢ┤ņŚÉ ņØśĒĢ£ ņŚÉļäłņ¦ĆņĀäĒÖś ņāØņé░ĻĖ░ņłĀņØä ļČĆĻ░ü ļÉśņ¢┤ņ¦ĆĻ│Ā ņ׳ļŗż. ļŗ©ņł£ ņåīĻ░ü, ļ¦żļ”Įļ│┤ļŗżļŖö ņ£ĀņÜ®ĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ ņ×¼ĒÖ£ņÜ® ĻĖ░ņłĀ ļ░Å ņ×ÉņøÉĒÖö ļō▒ņØś ĒĢäņÜöņä▒ņØ┤ ņ╗żņ¦ĆĻ│Ā ņ׳ļŗż. ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØä ļ¦żļ”ĮĒĢśĻ▓ī ļÉśļ®┤ ĒĢ┤ņ¢æ, ĒåĀņ¢æņśżņŚ╝, ņåīĻ░üņ▓śļ”¼ ĒĢĀļĢīļŖö ņ¦łņåīņé░ĒÖöļ¼╝(NOx), ĒÖ®ņé░ĒÖöļ¼╝(SOx), ļŗżņØ┤ņśźņŗĀ, ņŚ╝ņåī(Cl) ļō▒ ĒÖśĻ▓ĮņŚÉ ņ£ĀĒĢ┤ĒĢ£ ņśżņŚ╝ļ¼╝ņ¦łļōż ļ░£ņāØĒĢśĻ│Ā ņ׳ļŗż(Brennan et al., 2001). 2030~2050ļģäļÅä Ēāäņåīņżæļ”Įņŗ£ļīĆ ļ¦×ņČöņ¢┤ ņŚÉļäłņ¦ĆĻ▓ĮņĀ£Ļ░Ć ļīĆļæÉļÉśļ®┤ņä£ ņĄ£ĻĘ╝ ĻĄŁļé┤ņŚÉņä£ ņł£ĒÖśĻ▓ĮņĀ£ņØä ņ£äĒĢ£ ņ×ÉņøÉņł£ĒÖśĻĖ░ļ│Ėļ▓Ģ ļō▒ ņ×¼ĒÖ£ņÜ® ņŚ░ĻĄ¼Ļ░£ļ░£ņØä ĒåĄĒĢ£ ņé¼ņŚģ ļō▒ņØä ņČöņ¦äĒĢśĻ│Ā ņ׳ļŗż(Kan et al., 2016). ĒŖ╣Ē׳, ņĄ£ĻĘ╝ ņ£ĀĻ░ĆĻĖēļō▒Ļ│╝ ņĀĢļČĆņØś ņĀüĻĘ╣ņĀüņ£╝ļĪ£ ņ×¼ĒÖ£ņÜ® ņĀĢņ▒ģ ļō▒ņØś ņŻ╝ņ£ä ĒÖśĻ▓Į ļ│ĆĒÖöņŚÉ ļö░ļØ╝ ņŚ┤ļČäĒĢ┤ņŚÉ ņØśĒĢ┤ ļīĆņ▓┤ ņłśņåī ļō▒ņ£╝ļĪ£ ĒÅÉņ×ÉņøÉņĀäĒÖśļ░®ļ▓ĢņØ┤ ņóŗņØĆ ļīĆņĢłņØ┤ ļÉśĻ│Ā ņ׳ļŗż. ņØ┤ļź╝ ļ░śņśüĒĢśļō»ņØ┤ ņ¦Ćņ¦Ćņ▓┤, Ļ┤ĆļĀ© ĒÖśĻ▓Įļŗ©ņ▓┤, ņĀĆĻĖ░ņłĀņ×Éļōż, ņØ┤ņÖĆ Ļ┤ĆļĀ© ņĀĢļČĆ(ņé░ņŚģļČĆ, ĒÖśĻ▓ĮļČĆ ļō▒), ņĀĢļČĆĻĖ░Ļ┤Ć ļ░Å ļīĆ, ņżæņåīĻĖ░ņŚģņŚÉņä£ ĒÅÉĒöīļØ╝ņŖżĒŗ▒ ņŚ┤ļČäĒĢ┤ ņŚ░ĻĄ¼Ļ░£ļ░£ ļ░Å ņé¼ņŚģĻ░£ļ░£ņŚÉ ļ¦ÄņØĆ Ļ┤Ćņŗ¼ņØ┤ ļ│┤ņŚ¼ņ¦ĆĻ│Ā ņ׳ļŗż(Kim et al., 2004). ņøÉņ£Ā ņä▒ļČäņØĖ ĒāäĒÖöņłśņåīļĪ£ ĻĄ¼ņä▒ļÉ£ ĒöīļØ╝ņŖżĒŗ▒ņØś ņé¼ņÜ®ļ¤ē ņ”ØĻ░ĆļĪ£ ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØä ļ░£ņāØļ¤ēļÅä ņ”ØĻ░ĆĒĢśņśĆļŗż. ņĄ£ĻĘ╝ ņ£ĀĻ░ĆĻĖēļō▒Ļ│╝ ņŚÉļäłņ¦ĆņĀĢņ▒ģ ļō▒ ņŻ╝ņ£ä 2050 Ēāäņåīņżæļ”Į ĒÖśĻ▓Įļ│ĆĒÖöņŚÉ ļö░ļØ╝ ņŚ┤ļČäĒĢ┤ņŚÉ ņØśĒĢ┤ ļīĆņ▓┤ņŚÉļäłņ¦ĆņøÉņ£╝ļĪ£ ņĀäĒÖśĒĢśļŖö ņóŗņØĆ ļīĆņĢłņ£╝ļĪ£ ļÉśĻ│Ā ņ׳ļŗż.
ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØś ņŚ░ļŻīĒÖöļŖö Ļ│Ā ņĀÉņ░®ņä▒ ļ░Å ņŚ╝ņåīņä▒ļČäņØ┤ ļōżņ¢┤ņ׳ņ¢┤ ĒÅÉņ×ÉņøÉņ£╝ļĪ£ ļ░£ņāØļÉśļŖö ļ╣äļŗÉļźśņŚÉ ļ╣äĒĢ┤ ņĀüņĀłĒĢśĻ▓ī ņŚÉļäłņ¦ĆĒÖö ļÉśņ¦Ć ļ¬╗ĒĢśĻ│Ā ņ׳ļŖö ņŗżņĀĢņØ┤ļŗż(Kim et al., 2004). ĒÅÉĒöīļØ╝ņŖżĒŗ▒ ļ░Å ĒÅÉļ╣äļŗÉĻ│╝ ļ╣äņŖĘĒĢ£ ņĪ░ņä▒ņØä Ļ░Ćņ¦ä Ēś╝ĒĢ®ĒĢ£ ņŗ£ļŻīļź╝ ļ░öĒāĢņ£╝ļĪ£ ņ┤ēļ¦żņØś ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢśņŚ¼ ĒāäĒÖöņłśņåīĻ░Ć ņĀüņØĆ ņś¼ļĀłĒĢĆņØś ņłśņ£©ņØä Ē¢źņāüņŗ£ĒéżĻ│Ā, ĒÖöĒĢÖņĀü ņøÉļŻīļĪ£ ņé¼ņÜ® Ļ░ĆļŖźĒĢ£ ņłśņåī ļ░Å ļ░®Ē¢źņĪ▒ ĒÖöĒĢ®ļ¼╝ņØś ņłśņ£©ņØä ļåÆņØ┤ļŖöļŹ░ ņ׳ļŗż. ņŚ┤ļČäĒĢ┤ņŚÉņä£ ņ┤ēļ¦żņØś ņŚŁĒĢĀĻ│╝ Ļ│ĄņĀĢņŚÉņä£ ņ£Āļ”¼ĒĢ£ ņĄ£ņĀü ņ┤ēļ¦żļź╝ ņäĀņĀĢĒĢśļŖöļŹ░ ĒÖ£ņÜ®ĒĢśĻ│Āņ×É ĒĢ£ļŗż. ĒÅÉĒöīļØ╝ņŖżĒŗ▒ ļ░Å ĒÅÉļ╣äļŗÉ, Ļ░ĆņĀĢ ļō▒ņŚÉņä£ ļ░£ņāØļÉśļŖö Ļ░ĆņŚ░ņä▒ĒÅÉĻĖ░ļ¼╝ ņżæņŚÉņä£ ņŚÉļäłņ¦Ć ĒĢ©ļ¤ēņØ┤ ļåÆņØĆ ĒÅÉĻĖ░ļ¼╝ ļīĆņāüņ£╝ļĪ£ ĒĢśņŚ¼ ņŚ░ļŻīņØś ņĀ£ņĪ░ĻĖ░ņłĀ, ņŚ┤ļČäĒĢ┤ņŚÉ ņØśĒĢ£ ņłśņåīĒÖöĻĖ░ņłĀ, Ļ░ĆņŖżĒÖöņŚÉ ņØśĒĢ£ Ļ░ĆņŚ░ņä▒ Ļ░ĆņŖż ņĀ£ņĪ░ĻĖ░ņłĀļō▒ ņ▓śļ”¼ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ│Āņ▓┤ņŚ░ļŻī, ņĢĪņ▓┤ņŚ░ļŻī, Ļ░ĆņŖżņŚ░ļŻī ļō▒ ņāØņé░ĒĢśĻ│Ā ņØ┤ļź╝ ņé░ņŚģ ņāØņé░ĒÖ£ļÅÖņŚÉ ĒĢäņÜ®ĒĢ£ ņŚÉļäłņ¦ĆļĪ£ ņØ┤ņÜ®ļÉĀ ņłś ņ׳ļÅäļĪØ ĒĢ£ ņ×¼ņāØņŚÉļäłņ¦Ćļź╝ ņé¼ņÜ®ĒĢśĻ│Āņ×ÉĒĢśļŖö ņØśļ»ĖĻ░Ć ņ׳ļŗż. ĒĢ®ņä▒Ļ░ĆņŖż(Syngas)ļŖö ĒÅÉĒöīļØ╝ņŖżĒŗ▒, ĒÅÉļ╣äļŗÉ, ĒÅÉĻ│Āļ¼┤, ĒÅÉĒāĆņØ┤ņ¢┤ ļō▒ņØś Ļ│ĀļČäņ×ÉĒÅÉĻĖ░ļ¼╝ņØä ļ¼┤ņé░ņåī(Vacuum)ņĪ░Ļ▒┤ ĒĢśņŚÉņä£ 350~450Ōäā ņøÉļŻīļź╝ ĻĄ¼ņä▒ĒĢśņśĆļŗż(Encinar & Gonxalez, 2008). ļČłĒżĒÖö ĒāäĒÖöņłśņåī ņé¼ņŖ¼ņØä ļüŖņ¢┤ņä£ ņĀĆļČäņ×ÉļĪ£ ļ¦īļō£ļŖö ņŚ┤ļČäĒĢ┤ Ļ│ĄņĀĢņØä ĒåĄĒĢśņŚ¼ ņĢĪņ▓┤ņŚ░ļŻīļĪ£ ļ│ĆĒÖśņŗ£ĒéżļŖö ĻĖ░ņłĀļĪ£ņä£ ņāØņä▒ļÉ£ ņśżņØ╝ņØĆ ņŻ╝ļĪ£ ņé░ņŚģņÜ®ļō▒ ļīĆņ▓┤(ļ│┤ņĪ░ ņŚ░ļŻī) ļśÉļŖö ņ×ÉņøÉņł£ĒÖś ņŚÉļäłņ¦Ćļź╝ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŗż(Park et al., 2013). ĻĄŁļé┤ņŚÉņä£ļŖö ĻĖ░ņŚģ, ļ¼┤ļ”¼ĒĢ£ ļ│┤ĻĖēņČöņ¦ä, ņ▓śļ”¼ļ¼╝ļ¤ē ĒÖĢļ│┤ņØś ņ¢┤ļĀżņøĆ, ĒÅÉĻĖ░ļ¼╝ ņ▓śļ”¼ļ╣äņ¦ĆņøÉ, ĒÅÉĻĖ░ļ¼╝ ņØĖĒŚłĻ░Ć ļō▒Ļ│╝ Ļ░ÖņØĆ ļ│ĄĒĢ®ņĀüņØĖ ņÜöņØĖĻ│╝ ņ▓┤Ļ│äņĀüņØĖ ĻĖ░ņłĀņŚ░ĻĄ¼Ļ░£ļ░£Ļ│╝ ņŗżņÜ®ĒÖö ļ░Å ņé¼ņŚģĒÖöĻ░Ć ņŗżņĀüņØ┤ ņāüļŗ╣Ē׳ ļČĆņĪ▒ĒĢśņŚ¼ ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØś ņŚ┤ļČäĒĢ┤ ĻĖ░ņłĀņØ┤ ļīĆĒĢ£ ļ│┤ĻĖēņØ┤ ņŗ£ĻĖēĒĢ£ ņāüĒā£ņØ┤ļŗż.
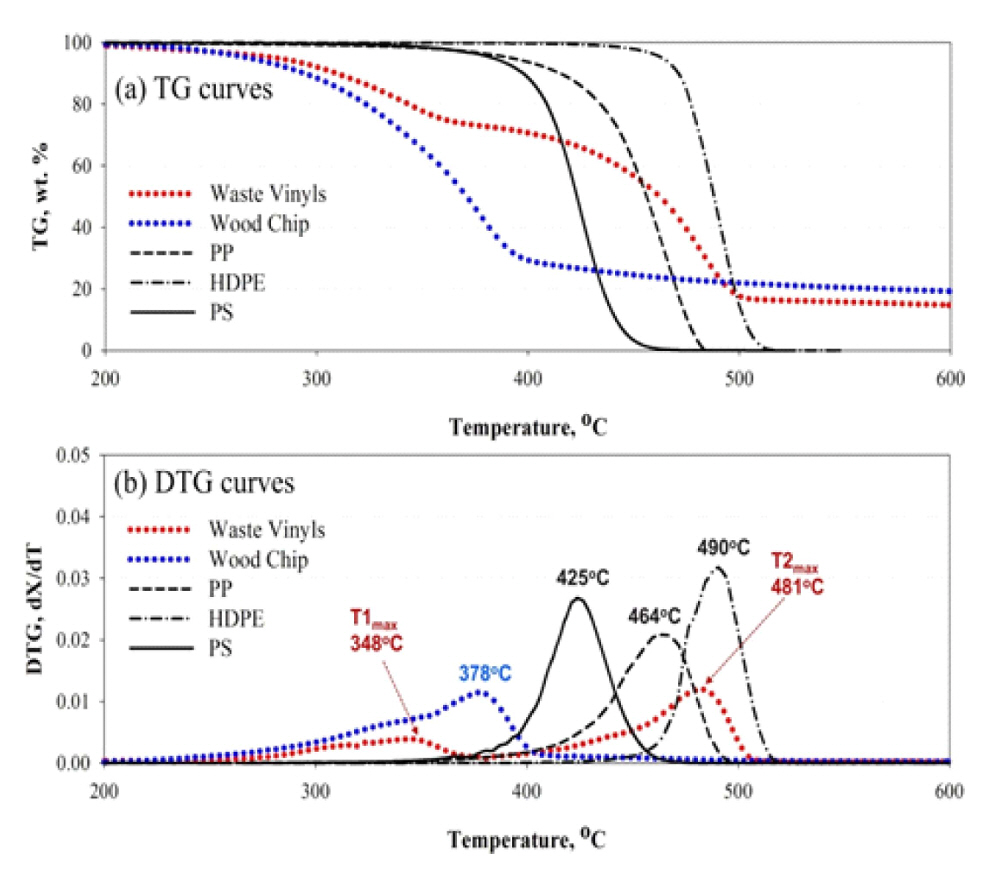
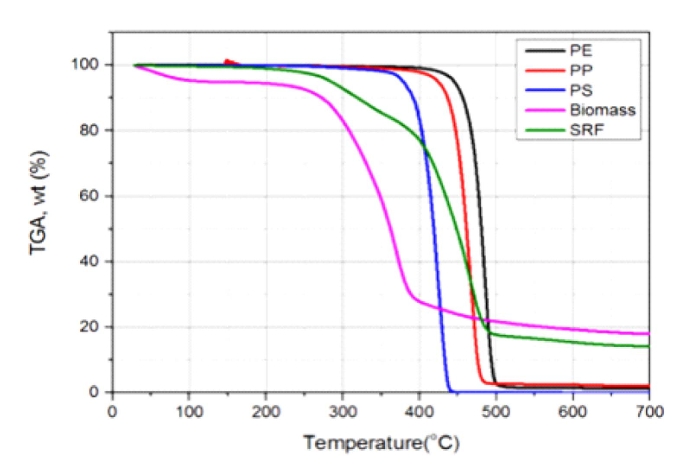
ĻĄŁļé┤ ĒÅÉĒöīļØ╝ņŖżĒŗ▒ ļ░£ņāØļ¤ē ņżæ ņĢĮ 500ļ¦īĒåżņŚÉņä£ ņĢĮ 50% ņĀĢļÅäĻ░Ć ņĢäņ¦üļÅä ļ¦żļ”ĮĻ│╝ ņåīĻ░üņŚÉ ņØśĒĢśņŚ¼ ņ▓śļ”¼ĒĢ£ļŗż(Al-Salem & Lettieri, 2010). ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØ┤ļōż ļ▓öņÜ® ĒÅÉĒöīļØ╝ņŖżĒŗ▒ ņŚ┤ļČäĒĢ┤ ņŗżĒŚśņØä ņŗżņŗ£ĒĢśņŚ¼ ĒŖ╣ņä▒ ĻĘ£ļ¬ģ ļ░Å ņ×ÉņøÉņŚ░ĻĄ¼ņØä ĒĢśņśĆļŗż. ņŚ┤ļČäĒĢ┤ļŖö PS > PP > PE ņł£ņä£ļĪ£ ņŚ┤ļČäĒĢ┤ ņś©ļÅäļŖö PS, PPņØś Ļ▓ĮņÜ░ 390Ōäā, PE Ļ▓ĮņÜ░ 430ŌäāĻ░Ć ņĀüņĀĢĒĢśņśĆņ£╝ļ®░(Al-Salem & Lettieri, 2010), ĒĢ®ņä▒ņśżņØ╝ ņāØņä▒ļ¼╝ņØś ņłśņ£©ņØĆ 80% ļ▓öņ£äļĪ£ ļåÆņĢśļŗż. PEņØś Ļ▓ĮņÜ░ ņÖüņŖżĻ░Ć ļŗżļ¤ē ĒżĒĢ©ļÉ£ ļäōņØĆ ļČäņ×Éļ¤ē ļČäĒżļĪ£ ĒīīļØ╝ĒĢĆĻ│╝ ņś¼ļĀłĒĢĆņØ┤ņŻ╝ ņāØņä▒ļ¼╝ļĪ£ ņŚ┤ļČäĒĢ┤ņØś ņ¢┤ļĀżņøĆņØ┤ ņ׳ņŚłļŗż. ļ░śļ®┤, PPņØś Ļ▓ĮņÜ░ļŖö ņĀĆļČäņ×É ņāØņä▒ļ¼╝ņØ┤ ņś¼ļĀłĒĢĆņØ┤ ņŻ╝ļĪ£ ņ¢╗ņ¢┤ņĪīĻ│Ā, ļśÉĒĢ£ PSņØś Ļ▓ĮņÜ░ļÅä ņĀĆļČäņ×ÉņØĖ ĒĢśļéśņØś ļ▓żņĀĀļ¦üņØä Ļ░Ćņ¦ä ņāØņä▒ļ¼╝ņØ┤ ņŻ╝ļĪ£ ņ¢╗ņ¢┤ņĪīņ£╝ļ®░, ņØ┤ ļæÉ ļ¼╝ņ¦łņØĆ 400Ōäā ņŚ┤ļČäĒĢ┤Ļ░Ć ņÜ®ņØ┤ĒĢśņśĆļŗż(Kim et al., 2014). ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØĆ ļåÆņØĆ ņŚ┤ļ¤ēņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö ļ▓öņÜ®ņØĖ PE, PP, PSĻ░Ć ņŻ╝ ļ░£ņāØņØ┤Ļ│Ā, ņŚ┤ļČäĒĢ┤ Ļ░ĆĒÖöĻĖ░ņŚÉņä£ ņ¢┤ļĀżņøĆņØ┤ ņ׳ļŖö PEņŚÉ ņ┤ēļ¦żļź╝ ļČĆĻ░ĆĒĢ£ Ļ▓ĮņÜ░ ļČäĒĢ┤ ļ░śņØæņØ┤ ņל ņØ┤ļŻ©ņ¢┤ņĪīĻ│Ā, ņŚ┤ļČäĒĢ┤ņŚÉ ļ╣äĒĢ┤ ņĀĆļČäņØĖ ņś¼ļĀłĒĢĆĻ│╝ ļ░®Ē¢źņĪ▒ ļČäņ£©ņØ┤ ļåÆņĢä ņ┤ēļ¦ż ļČĆĻ░ĆĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.
ļīĆņāü ņŗ£ļŻīņØś ņŚ┤ņżæļ¤ēļČäņäØĻĖ░(TGA) ņŖ╣ņś©ņ£© 20Ōäā/minņŚÉņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ 5Ļ░Ćņ¦Ć ņŗ£ļŻīņØś ņŚ┤ņżæļ¤ē(Thermogravimetric, TG) Ļ│ĪņäĀĻ│╝ ņŚ┤ņżæļ¤ē(Derivative TG, DTG) Ļ│ĪņäĀņØä ļÅäņŗ£ĒĢśĻ│Ā ņ׳ļŗż. ļ░śļ®┤ ĒÅÉļ╣äļŗÉņØś Ļ▓ĮņÜ░ ĒāĆ ņŗ£ļŻīņÖĆ ļŗ¼ļ”¼ ļäōņØĆ ņś©ļÅäļ▓öņ£äņŚÉņä£ ļČäĒĢ┤Ļ░Ć ņØ╝ņ¢┤ļé©ņØä ņĢī ņłś ņ׳ņ£╝ļ®░(Vega et al., 1996), TG ļ░Å DTG Ļ│ĪņäĀņØä ĒåĄĒĢ┤ ĒÅÉļ╣äļŗÉņØś ņŚ┤ļČäĒĢ┤ ļ░śņØæņØĆ Ēü¼Ļ▓ī 2ļŗ©Ļ│äļĪ£ ĻĄ¼ļČäĒĢĀ ņłś ņ׳ļŗż.
StarchņÖĆ Starch/poly(ethylene-co-vinyl alcohol)ņØś Ēś╝ĒĢ®ņŗ£ ļŻīņØś ņŚ┤ņżæļ¤ēļČäņäØņØä ņłśĒ¢ēĒĢśņśĆņ£╝ļ®░, ĻĘĖ Ļ▓░Ļ│╝ ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØś 1ļŗ©Ļ│ä ļ¼┤Ļ▓īĻ░Éņåī ĻĄ¼Ļ░ä(220~380Ōäā)Ļ│╝ ļ¦żņÜ░ ņ£Āņé¼ĒĢ£ ņś©ļÅäļ▓öņ£ä(230~370Ōäā)ņŚÉņä£ StarchņØś ļČäĒĢ┤Ļ░Ć ņ¦äĒ¢ēļÉ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż. 2ļ▓łņ¦Ė ĻĄ¼Ļ░äņØĆ 380~500ŌäāļĪ£ TmaxņØś Ļ▓ĮņÜ░ PP(464Ōäā) ļ│┤ļŗż ļåÆĻ│Ā HDPE(490Ōäā)ļ│┤ļŗż ļé«ņØĆ 481ŌäāņŚÉņä£ ļéśĒāĆļé©ņØä ĒÖĢņØĖĒĢśņśĆļŗż.
ĒÅÉĒöīļØ╝ņŖżĒŗ▒ ņżæ ņŚ┤ņĀüņĢłņĀĢļÅäļŖö HDPEĻ░Ć Ļ░Ćņן ļåÆņĢśņ£╝ļ®░, PP, PS ņł£ņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ņØ┤ļŖö Ļ░£ļ│ä ĒöīļØ╝ņŖżĒŗ▒ņØ┤ Ļ░¢ļŖö ļČäņ×ÉĻĄ¼ņĪ░ņØś ņ░©ņØ┤ņŚÉ ĻĖ░ņØĖĒĢ£ Ļ▓āņ£╝ļĪ£, PSņØś Ļ▓ĮņÜ░ ļ░śļ│Ą ļŗ©ņ£äņØĖ ļ▓żņĀĀĻ│Āļ”¼ļź╝ ļČäņ×É ļé┤ņŚÉ 50%ļź╝ ĒĢ©ņ£ĀĒĢśĻ│Ā ņ׳ņ¢┤ ļČäņ×ÉņØś Ļ▓░ņĀĢņä▒ņØä ļé«ņČöĻ│Ā(Yang et al., 2013) 3ņ░© ĒāäņåīņØś ļ╣äņ£©ņØä ļåÆņŚ¼ ņŚ┤ņĀü ņĢłņĀĢļÅäĻ░Ć ļ¢©ņ¢┤ņ¦äļŗż. ļ░śļ®┤ PPņØś Ļ▓ĮņÜ░ ļ░śļ│Ą ļŗ©ņ£äņØĖ ļ®öĒŗĖĻĖ░ņŚÉ ņØśĒĢ┤ HDPEņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ Ļ▓░ņĀĢņä▒ņØ┤ ļé«Ļ│Ā 3ņ░© ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØ┤ ļåÆņĢä ņŚ┤ņĀüņĢłņĀĢļÅäĻ░Ć HDPEļ│┤ļŗż ļ¢©ņ¢┤ņ¦ÉņØä ņĢī ņłś ņ׳ļŗż.
Figure 4ļź╝ ĒåĄĒĢ┤ ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØś 2ļ▓łņ¦Ė ņŚ┤ļČäĒĢ┤(phase ļ│ĆĒÖö)ĻĄ¼Ļ░äņØĆ ņŚ┤ņĀüņĢłņĀĢļÅä ņ░©ņØ┤Ļ░Ć ņ׳ļŖö 3Ļ░Ćņ¦Ć ļ▓öņÜ® ĒöīļØ╝ņŖżĒŗ▒ņØ┤ Ļ░£ļ│äņĀüņ£╝ļĪ£ ļČäĒĢ┤ļÉśļŖö ļ¬©ļōĀ ņś©ļÅäĻĄ¼Ļ░äņØä ĒżĒĢ©ĒĢ©ņØä ņĢī ņłś ņ׳ņ£╝ļ®░, ņØ┤ņŚÉ ļö░ļØ╝ ļ│Ė ņŚ░ĻĄ¼ņØś ļīĆņāü ņŗ£ļŻīņØĖ ĒÅÉļ╣äļŗÉņØĆ ļŗ©ņØ╝ ĒöīļØ╝ņŖżĒŗ▒ņØ┤ ņĢäļŗī ļŗżņ¢æĒĢ£ ņóģļźśņØś ĒöīļØ╝ņŖżĒŗ▒ņØ┤ Ēś╝ņ×¼ļÉśņ¢┤ ņ׳ļŗżĻ│Ā ņŚ¼Ļ▓©ņ¦äļŗż(Ayllon et al., 2006). ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØś T2maxļ│┤ļŗż ļé«ņØĆ ņś©ļÅäņŚÉņä£ Tmaxļź╝ ņ¦ĆļŗłļŖö PPļź╝ ĒÅÉļ╣äļŗÉņØś ĒöīļØ╝ņŖżĒŗ▒ņ£╝ļĪ£ ņäżņĀĢĒĢśĻ│Ā, ĒÅÉļ╣äļŗÉņØś ļČäĒĢ┤ĻĄ¼Ļ░äņØś ļČäĒĢ┤ņŚÉ ņśüĒ¢źņØä ņŻ╝ļŖö ņä▒ļČäņØä ļ│┤ļŗż ļ¬ģĒÖĢĒĢśĻ▓ī ĻĘ£ļ¬ģĒĢśĻĖ░ ņ£äĒĢ┤ Ēś╝ĒĢ®ļ╣äņ£©ņØä ļŗ¼ļ”¼ĒĢśņŚ¼ ņŚ┤ļČäĒĢ┤ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. 20Ōäā/minņŚÉņä£ ĒÅÉĒöīļØ╝ņŖżĒŗ▒, Ēöäļ”¼ĒöäļĪ£ĒĢäļĀī(PP)ņŚ┤ļČäĒĢ┤ņŚÉ ĻĖ░ņØĖĒĢ£ 2ļ▓łņ¦Ė ņś©ļÅäĻĄ¼Ļ░äņØĆ Ļ│Āņś©ņ£╝ļĪ£ ņØ┤ļÅÖĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļ░śņØæ ņóģļŻī ņŗ£ņĀÉņŚÉņä£ ĒÖ£ņä▒ĒÖöņŚÉļäłņ¦ĆĻ░Ć Ļ░ÉņåīĒĢśļŖö ĒÅÉļ╣äļŗÉĻ│╝ļŖö ļŗ¼ļ”¼ Ēś╝ĒĢ®ļ╣äņ£©ņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ļåÆņØĆ ņĀäĒÖśņ£©ņŚÉņä£ņØś ĒÖ£ņä▒ĒÖöņŚÉļäłņ¦Ć Ļ░ÆņØś ņ”ØĻ░ĆĻ░Ć ļæÉļō£ļ¤¼ņ¦ĆĻ▓ī ļéśĒāĆļé©ņØä ĒÖĢņØĖĒĢśņśĆļŗż.
ņŗżĒŚśļ░®ļ▓Ģ
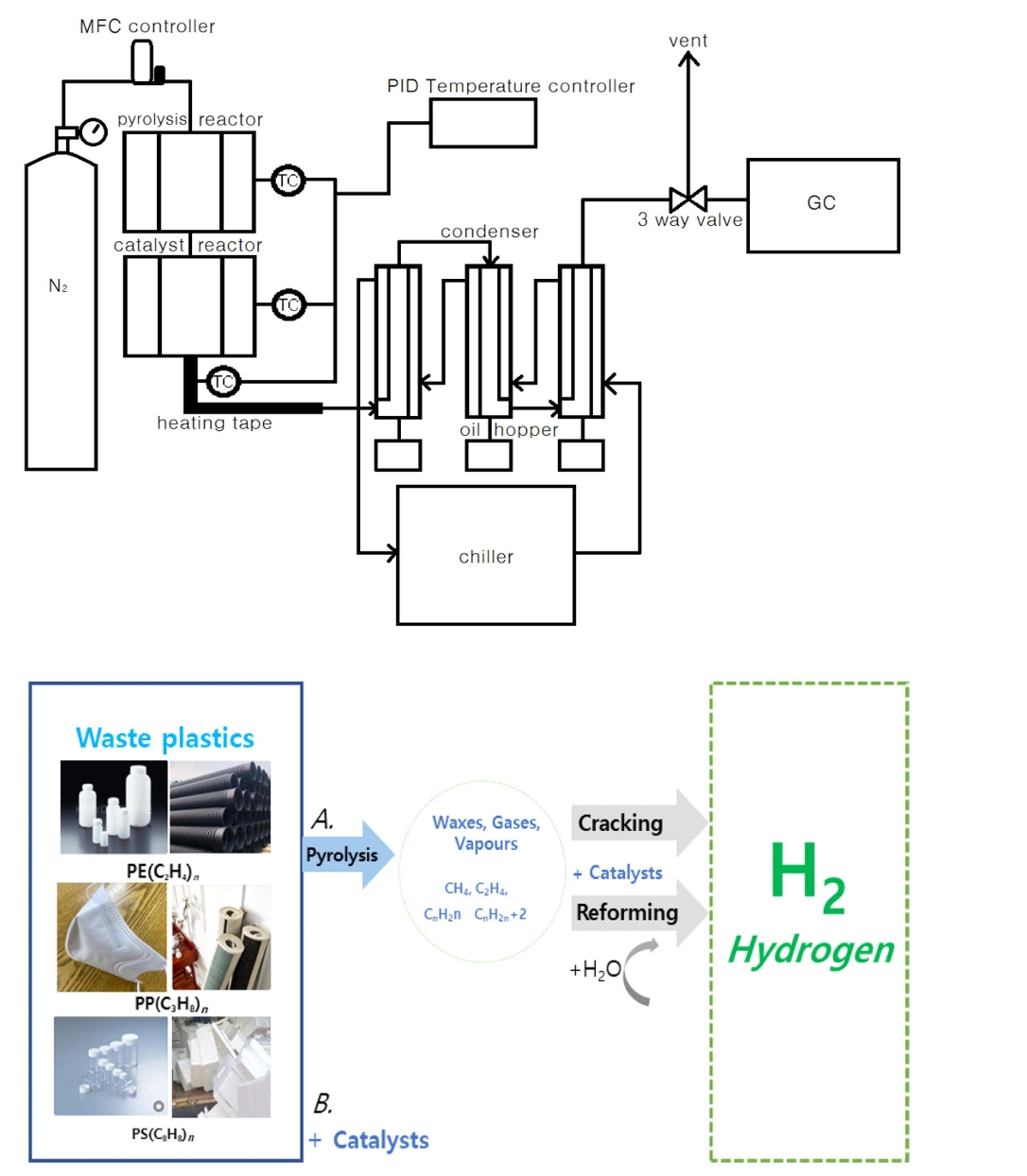
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņŚ┤ļČäĒĢ┤ ļ░śņØæ Ļ│ĄņĀĢņØĆ ļ░śņØæļ¼╝ ņ£ĀļÅÖņĖĄĻ░ĆņŖżĒÖö ļ░Å ņŚ┤ļČäĒĢ┤ ļ░śņØæĻĖ░, Ļ░£ņ¦łņ┤ēļ¦żļ░śņØæĻĖ░ļĪ£ ņØ┤ļŻ©ņ¢┤ņĀĖ ņ׳ļŗż. ļ│Ė ņŗżĒŚś ņןņ╣śļŖö Ļ░ĆņŖż ņĀ£ņ¢┤(MFC), ņś©ļÅä ņĀ£ņ¢┤(temperature controller), ņŚ┤ļČäĒĢ┤ ļ░śņØæ ņŗ£ņŖżĒģ£(pyrolysis reactor), ņ┤ēļ¦żĻ░£ņ¦ł ņŗ£ņŖżĒģ£(catalyst reactor), GCļČäņäØ ņŗ£ņŖżĒģ£ņ£╝ļĪ£ ĻĄ¼ņä▒ĒĢśņśĆļŗż. ņŚ┤ļČäĒĢ┤ ļ░śņØæĻĖ░ņØś ņČ£ņ×ģĻĄ¼ņŚÉ ņŚ░ņåŹņ£╝ļĪ£ ņäØņśüņ¦łņØś ņ┤ēļ¦żņĖĄ ļ░śņØæĻĖ░ļź╝ ņŚ░Ļ▓░ĒĢśņŚ¼ ņŚ┤ļČäĒĢ┤ ĻĖ░ņ▓┤Ļ░Ć Ļ░£ņ¦łļÉśļÅäļĪØ ņäżņ╣ś ļ░Å ĻĄ¼ņČĢ ĒĢśņśĆļŗż(Tsuge et al., 2011). ņ┤ēļ¦żņĖĄļ░śņØæĻĖ░ņØś ņČ£ĻĄ¼ņŚÉņä£ ņāØņä▒Ļ░ĆņŖżĻ░Ć ņŗżņś©ņ£╝ļĪ£ ļ¢©ņ¢┤ņĀĖ ņØæĻ│ĀļÉśļŖö Ļ▓āņØä ļ¦ēĻĖ░ ņ£äĒĢśņŚ¼ ņŚ┤ņäĀ ĒģīņØ┤Ēöäļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ condenserņ×ģĻĄ¼Ļ╣īņ¦Ć 200Ōäāļź╝ ņ£Āņ¦ĆĒĢśļÅäļĪØ ĒĢśņśĆļŗż. ņŚ┤ļČäĒĢ┤ļÉśņ¢┤ ņāØņä▒ļÉ£ Ļ░ĆņŖżļŖö condenserņŚÉ ņØśĒĢ┤ ļāēĻ░üļÉśņ¢┤ ĒĢ®ņä▒ ņśżņØ╝ņØä ļČäļ”¼ĒĢśņśĆļŗż.
Condenserļź╝ ņ¦Ćļéśņś© Ļ░ĆņŖżļŖö FIDņÖĆ TCDĻ░Ć ņןņ░®ļÉ£ GCļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢśņśĆņ£╝ļ®░, N2ļŖö ņ¦łļ¤ē ņ£Āļ¤ē ņĪ░ņĀłĻ│ä(MFC)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļ░śņØæĻĖ░ņŚÉ ņĀĢļ¤ē Ļ│ĄĻĖēĒĢśņśĆļŗż. ņŚ┤ļČäĒĢ┤ļ░śņØæĻĖ░ņŚÉņä£ ņ┤ēļ¦ż ļ░śņØæ ĒŖ╣ņä▒ ņŚ░ĻĄ¼ļź╝ ņ£äĒĢ┤ ņś©ļÅä, ņ▓┤ļźśņŗ£Ļ░ä, ņŚ┤ļČäĒĢ┤ ļ░śņØæ ņŗ£Ļ░ä ļō▒ ņŚ┤ļČäĒĢ┤ ņÜ┤ņĀä ņĪ░Ļ▒┤ņØä ņäĀņĀĢĒĢśņśĆļŗż(Kim et al., 2014). ņŗ£ļŻīļŖö PP(Density=0.9 g/mL at 25Ōäā, Mw=~250,000), LDPE(Density=0.925 g/mL at 25Ōäā, form: Pellets, Melt Index=25 g/10 min. mp=116Ōäā), HDPE(high Density Polyethylene, Density=0.952 g/mL at 25Ōäā, form: pellets, melt index=12 g/10 min, mp=125~140Ōäā)ņØä ņé¼ņÜ®ĒĢśņśĆņ£╝ļéś LDPEņÖĆ HDPEļŖö ņŚ┤ļČäĒĢ┤ņŗ£ ņÖüņŖż ņāØņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØä ĒīīņĢģĒĢĀ ņłś ņŚåĻĖ░ ļĢīļ¼ĖņŚÉ ĒÅ┤ļ”¼ĒöäļĪ£ĒĢäļĀīņ£╝ļĪ£ ņäĀņĀĢĒĢśņśĆļŗż.
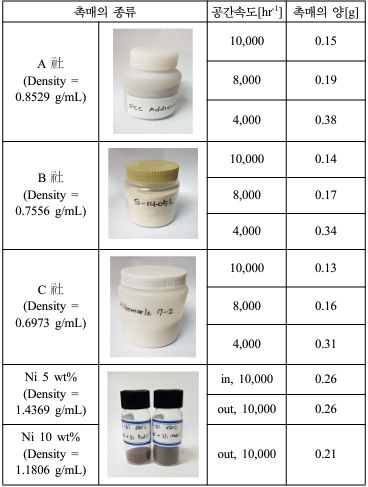
ņŚ┤ļČäĒĢ┤ļŖö ņśżņØ╝ ņāØņä▒ņŚÉ ņżæņĀÉņĀüņ£╝ļĪ£ ņŚ┤ļČäĒĢ┤ļĪ£ ĒĢśņśĆņ£╝ļ®░ ņŚ┤ļČäĒĢ┤ ņś©ļÅäļź╝ 480ŌäāļĪ£ ņäżņĀĢĒĢśņśĆļŗż. PPĻ░Ć ņŚ┤ļČäĒĢ┤ ļÉśņ¦Ć ņĢŖņØĆ ņāüĒā£ņŚÉņä£ ļ░śņØæĻĖ░ļź╝ ĒåĄĻ│╝ĒĢśļŖö Ļ▓āņØä ļ░®ņ¦ĆĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ļ░śņØæĻĖ░ņĢłņŚÉ ļÅäĻ░Ćļŗłļź╝ ņäżņ╣śĒĢśņśĆņ£╝ļ®░ ņ┤ēļ¦żņÖĆ ņĀæņ┤ēņŗ£Ļ░äņØä ļŖśļ”¼ĻĖ░ ņ£äĒĢśņŚ¼ carrier gasņØś ņ▓┤ļźśņŗ£Ļ░äņØä 30 cc/minņ£╝ļĪ£ ņäżņĀĢĒĢśņśĆļŗż(Tsuge et al., 2011). PPĻ░Ć ņČ®ļČäĒĢ£ ņŗ£Ļ░äņØä Ļ░Ćņ¦ĆĻ│Ā ņŚ┤ļČäĒĢ┤ļÉśĻĖ░ ņ£äĒĢśņŚ¼ ņŚ┤ļČäĒĢ┤ 90ļČäņ£╝ļĪ£ ĒĢśņśĆļŗż. ņ┤ēļ¦żļŖö ĻĄŁļé┤ņÖĖ ņ£Āņłś ņäØņ£ĀĒÖöĒĢÖĒÜīņé¼ AńżŠ, BńżŠ, CńżŠņŚÉņä£ ņé¼ņÜ®ļÉśļŖö ņāüņÜ® ņ┤ēļ¦żļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ņŗ£ļŻīņØś ņŚ┤ļČäĒĢ┤/ņ┤ēļ¦ż ļ░śņØæņØĆ ņäØņśü ņ×¼ņ¦łņØś fixed bed reactorņŚÉņä£ ņØ┤ļŻ©ņ¢┤ņĪīļŗż.
ņŗ£ļŻī(Ļ│ĀļČäņ×Éļ¼╝ņä▒)Ļ░Ć ļ│ĆĒÖöĻ░Ć ļÉśļ®┤ņä£ ņ£Āļ”¼ņĀäņØ┤ņś©ļÅä ļÅäĻ░Ćļŗł ņĢłņŚÉ ņŗ£ļŻīļź╝ ļäŻĻ│Ā, ņ┤ēļ¦ż ņĖĄ ļ░śņØæĻĖ░ņŚÉ ņ┤ēļ¦żļź╝ ļäŻņØĆ Ēøä ļ░śņØæĻĖ░ņŚÉ Ļ│ĀņĀĢņŗ£Ēé© Ēøä ņŗżĒŚś ņĀäņŚÉ ņ¦łņåīļź╝ 80 mL/minņ£╝ļĪ£ 60ļČä ņØ┤ņāü ĒØśļĀżņŻ╝ņ¢┤ ļ¼┤ņé░ņåī ņāüĒā£ļĪ£ ļ¦īļōżņ¢┤ ņŻ╝ņŚłļŗż. Pyrolysis reactorņØś ņś©ļÅäļŖö 600Ōäā, catalyst reactorņØś ņś©ļÅäļŖö 450~500ŌäāļĪ£ ĒĢśņśĆņ£╝ļ®░(Inguanzo et al., 2001), ņ¦łņåīņØś ņ£Āļ¤ēņØä 20 mL/minņ£╝ļĪ£ ļ│ĆĻ▓ĮĒĢśņŚ¼ ņŚ┤ļČäĒĢ┤ ļ░śņØæĻĖ░ļź╝ ņØ┤ļÅÖņŗ£ņ╝£ ĻĖēņåŹ ņŚ┤ļČäĒĢ┤ ļ░śņØæņØä ņŗ£ņ×æĒĢśņśĆļŗż. ņŚ┤ļČäĒĢ┤Ļ░Ć ņŗ£ņ×æļÉśĻ│Ā 90ļČäļÅÖņĢł ļ░£ņāØļÉśļŖö vaporļŖö condenserļź╝ ņ¦Ćļéśļ®┤ņä£ ļāēĻ░üļÉśņ¢┤ ņśżņØ╝ņØä ļČäļ”¼ĒĢśņśĆņ£╝ļ®░ condenserņØś ņś©ļÅäļŖö -10Ōäāļź╝ ņ£Āņ¦ĆĒĢśņśĆļŗż. Condenserļź╝ Ļ▒░ņ│É ņĢĪĒÖöļÉśņ¦Ć ņĢŖņØĆ Ļ░ĆņŖżļŖö Ļ░ĆņŖżļ░▒ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ēżņ¦æĒĢśņśĆļŗż. ļČäļ”¼ļÉ£ ņśżņØ╝ņØĆ GC/MS(Gas Chromatography/Mass Spectrometry)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņä▒ļČäņØä ļČäņäØĒĢśņśĆĻ│Ā, Ēżņ¦æĒĢ£ Ļ░ĆņŖżļŖö GCļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż. ņŚ┤ļČäĒĢ┤ Ļ░ĆņŖżĒÖö ņł£ĒÖś ņ£ĀļÅÖņĖĄ ļ░śņØæĻĖ░ļŖö ļé┤ļČĆ ņł£ĒÖśĒśĢ ļ░śņØæĻĖ░ņØś ĒśĢĒā£ļĪ£ ņäżĻ│äļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. ĒĢ£ņ¬ĮņØĆ ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØś ņŚ┤ļČäĒĢ┤ļĪ£, ļŗżļźĖ ļ░śņ¬ĮņØĆ ņ£ĀļÅÖņĖĄ Ļ░ĆņŖżĒÖöļĪ£ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŗż. ļ░śņØæĻĖ░ļŖö ĻĖ░Ēż ņ£ĀļÅÖņĖĄ(Bubbling Fluidized Bed)ņ£╝ļĪ£ Ļ░ĆņŖżĒÖöļĪ£ņŚÉņä£ ņāØņä▒ļÉśļŖö 650~800Ōäā ņ£ĀļÅÖņé¼ļź╝ ņŚ┤ļČäĒĢ┤ ļ░śņØæĻĖ░ļĪ£ ņØ┤ņåĪĒĢśņŚ¼ ĒÅÉĻĖ░ļ¼╝ņØä ņ¦üņĀæ ņŚ┤ļČäĒĢ┤ĒĢśĻ│Ā(Al-Salem & Lettieri, 2010) ņŚ┤ļČäĒĢ┤ļĪ£ Ēøä ļ░░ņČ£ļÉśļŖö ņ£ĀļÅÖņé¼/ņ×öņ£Āļ¼╝(char)ļŖö ļŗżņŗ£ Ļ░ĆņŖżĒÖö ņ£ĀļÅÖņĖĄņ£╝ļĪ£ ņØ┤ļÅÖĒĢśņŚ¼ ĒĢ®ņä▒Ļ░ĆņŖżļź╝ ņāØņä▒ĒĢĀ ņłś ņ׳ļÅäļĪØ ĒĢśņśĆļŗż. ņŚ┤ļČäĒĢ┤Ļ░Ć ņ¦äĒ¢ēļÉśņ¢┤ ņāØņä▒ļÉ£ ļ»Ėļ░śņØæ charĻ░Ć ņŚ░ņåīļĪ£ļĪ£ ņł£ĒÖśļÉśņ¢┤, ņ£ĀļÅÖĒÖö ļ¦żņ▓┤ņØĖ Ļ│ĄĻĖ░ņÖĆ ĒĢ©Ļ╗ś ņŚ░ņåīĒĢśņŚ¼ ņś©ļÅäļź╝ ņ£Āņ¦ĆĒĢĀ ņłś ņ׳ļÅäļĪØ ĒĢśņśĆļŗż.
1. ņŚ┤ & ļ¼╝ņ¦łņłśņ¦Ć(Heat & Mass Balance) ļÅäņČ£
Ļ░ĆņŖżĒÖöļĪ£ ņŚ┤ ņłśņ¦Ć Ļ│äņé░ņØĆ ņŚ┤ļČäĒĢ┤ļĪ£ņŚÉņä£ ņāØņä▒ļÉ£ charņØś ņÖäņĀä ņŚ░ņåīņĪ░Ļ▒┤ņ£╝ļĪ£ ļ©╝ņĀĆ ņŚ┤ņĀĢņé░ņØä ĒĢ£ Ēøä ĒĢäņÜöĒĢ£ ņŚ┤ļ¤ē Ļ░ÆņØä Ļ│äņé░ĒĢśņŚ¼ ņČöĻ░Ć Ēł¼ņ×ģņŚ┤ļ¤ēņØä Ļ│äņé░ĒĢśņśĆļŗż.
Si ņ¦Ćņ¦Ćņ▓┤ļź╝ ĻĖ░ļ░śņ£╝ļĪ£ ĒĢśļŖö ņŚ┤ļČäĒĢ┤ņÜ® ņ┤ēļ¦żļź╝ ĒĢ®ņä▒ņØä ņ£äĒĢśņŚ¼ silica sandņÖĆ ņĀäņØ┤ĻĖłņåŹļ¼╝ņ¦łņØĖ NiņØä ļŗ┤ņ¦ĆĒĢśņśĆļŗż. NiņØĆ 5 wt%ļĪ£ ĒĢśņŚ¼ evaporatorļź╝ ņØ┤ņÜ®ĒĢ┤ ļ¼╝ļ”¼ņĀüņ£╝ļĪ£ Ēś╝ĒĢ®ĒĢśņśĆļŗż. ļ¼╝ļ”¼ņĀüņ£╝ļĪ£ ļŗ┤ņ¦ĆĒĢ£ Ēś╝ĒĢ®ļ¼╝ņØä ņśżļĖÉņŚÉ ļäŻĻ│Ā 24ņŗ£Ļ░ä Ļ▒┤ņĪ░ņŗ£Ēé© Ēøä, 650ŌäāņŚÉņä£ 3ņŗ£Ļ░ä ļÅÖņĢł ņåīņä▒ņŗ£ņ╝░ļŗż.
ņŚ┤ļČäĒĢ┤ Ļ│ĄņĀĢņŚÉņä£ ņ┤ēļ¦żĻ░Ć ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ Ļ│ĄĻ░äņåŹļÅäņŚÉ ļö░ļØ╝ ņ┤ēļ¦żņØś ņ¢æņŚÉ ļ│ĆĒÖöļź╝ ņŻ╝ņ¢┤ ņŚ┤ļČäĒĢ┤ņŚÉ ņØ┤ņÜ®ĒĢśņśĆļŗż. Ļ│ĄĻ░äņåŹļÅäļŖö ņ┤ēļ¦żņØś Ļ▓ēļ│┤ĻĖ░ ļ░ĆļÅäļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ┤ēļ¦żņØś ļČĆĒö╝ļź╝ ņ×░ Ēøä, carrier gasņØś flow rateļź╝ ļČĆĒö╝ļĪ£ ļéśļłäņ¢┤ ņĢī ņłś ņ׳ļŗż. ņé¼ņÜ®ļÉ£ ņ┤ēļ¦żņØś ņóģļźśņÖĆ ņ¢æņØä ļéśĒāĆļé╝ ņłś ņ׳ņŚłņ£╝ļ®░ ņĢäļלņÖĆ Ļ░ÖņØ┤ Ļ│ĄņŗØņØä ļÅäņČ£ĒĢĀ ņłś ņ׳ņŚłļŗż.
2. ņŚ┤ļČäĒĢ┤ ĻĖ░ņ┤łņŗżĒŚś ļ░Å ņłśņ£©ļ╣äĻĄÉ ņŗżĒŚśĻ▓░Ļ│╝
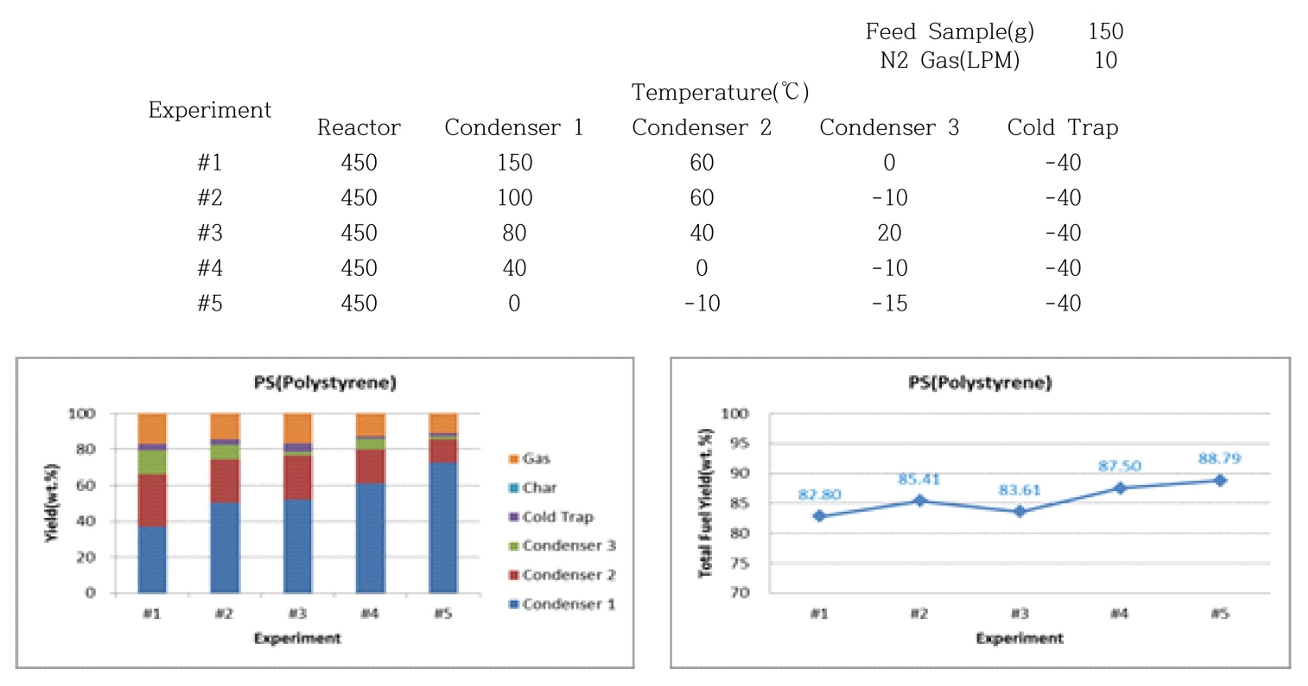
ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØś 500 ml ļ░śņØæĻĖ░ņŚÉņä£ ņĄ£ļīĆ 30~150 gņØś ņŗ£ļŻī ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, 3Ļ░£ņØś ļāēĻ░üĻĖ░ļĪ£ ņØæņČĢĒĢśņŚ¼ ņś©ļÅäļź╝ ņĀ£ņ¢┤ĒĢśņśĆļŗż.
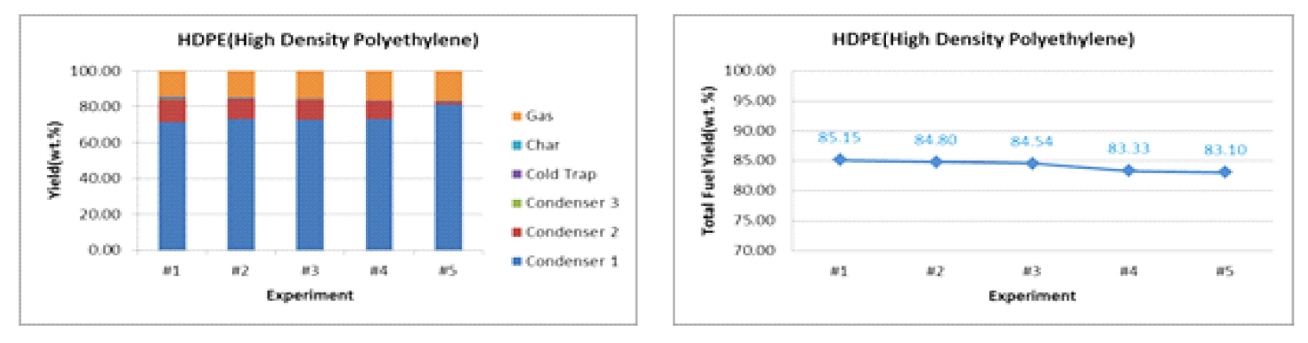
ņś©ļÅäĻ░Ć Ļ░ÉņåīĒĢĀņłśļĪØ ņØæņČĢĻĖ░ņŚÉņä£ ĒÜīņłśļÉśļŖö ņśżņØ╝ņłśņ£©ņØ┤ ņ”ØĻ░ĆĒĢśļ®┤ņä£ ņ┤Ø ņśżņØ╝ņłśņ£©ņØĆ ņ”ØĻ░ĆĒĢśņśĆļŗż. ĒÅ┤ļ”¼ņŖżĒŗ░ļĀī(PS)ņśżņØ╝ņłśņ£©ņØĆ ņĄ£Ļ│Ā 88.79%ņ£╝ļĪ£ ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØś ņśżņØ╝ņāØņä▒ ņłśņ£©ņØĆ ĒÅēĻĘĀņĀüņ£╝ļĪ£ 85%ņØ┤ļŗż.
Ļ│Āļ╣äņĀÉ ņśżņØ╝(ņÖüņŖż)ņØ┤ ņāØņä▒ņŚÉ ĒāäĒÖöņłśņåī(C2~C5) ņØ┤ņāüņØś ņÖüņŖżņä▒ļČäņØ┤ ņāüļŗ╣ļ¤ē ņāØņä▒ĒĢśņśĆņ£╝ļ®░, ņś©ļÅäĻ░Ć Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░, ņ┤Ø ņśżņØ╝ņłśņ£©ņØĆ ņĄ£Ļ│Ā 85.15%ļĪ£ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņ┤ēļ¦żņØś ņ¢æĻ│╝ ņóģļźśļź╝ ļŗżļź┤Ļ▓ī ĒĢśļ®┤ņä£ ņŚ┤ļČäĒĢ┤ ļ░śņØæņØä ĒåĄĒĢ┤ ņāØņä▒ļÉśļŖö ņ£ĀņÜ®ĒĢ£ ņä▒ļČäņØś ņśżņØ╝ ņāØņä▒ņØ┤ Ļ░Ćņן ļ¦ÄņØĆ ņ┤ēļ¦żļź╝ ņäĀņĀĢĒĢśĻ│Āņ×É Ē¢łļŗż. PPļź╝ ņØ┤ņÜ®ĒĢ┤ ņ┤ēļ¦ż ņŚåņØ┤ ņŚ┤ļČäĒĢ┤ļź╝ ņłśĒ¢ēĒĢśļ®┤ ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØĆ 70.19 wt%ļĪ£ ļ¦ÄņØĆ ņśżņØ╝ņØ┤ ņāØņä▒ļÉśņŚłņ£╝ļéś Ē£śļ░£ņ£ĀņØś ņĪ░ņä▒Ļ│╝ ņ£Āņé¼ĒĢ£ ņ£ĀļČäņØĖ C5~C14Ļ░Ć 29.53%ņØ┤Ļ│Ā ĒāäĒÖöņłśņåīĻ░Ć 17Ļ░£ ņØ┤ņāüņØś ņÖüņŖż(Wax)ņä▒ļČäņØś ĒāäĒÖöņłśņåīĻ░Ć 70.47%ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ä Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż.
3. ĒāĆņé¼ņØś ņ┤ēļ¦żņŚÉ ļö░ļźĖ ĒŖ╣ņä▒ ĒÅēĻ░Ć
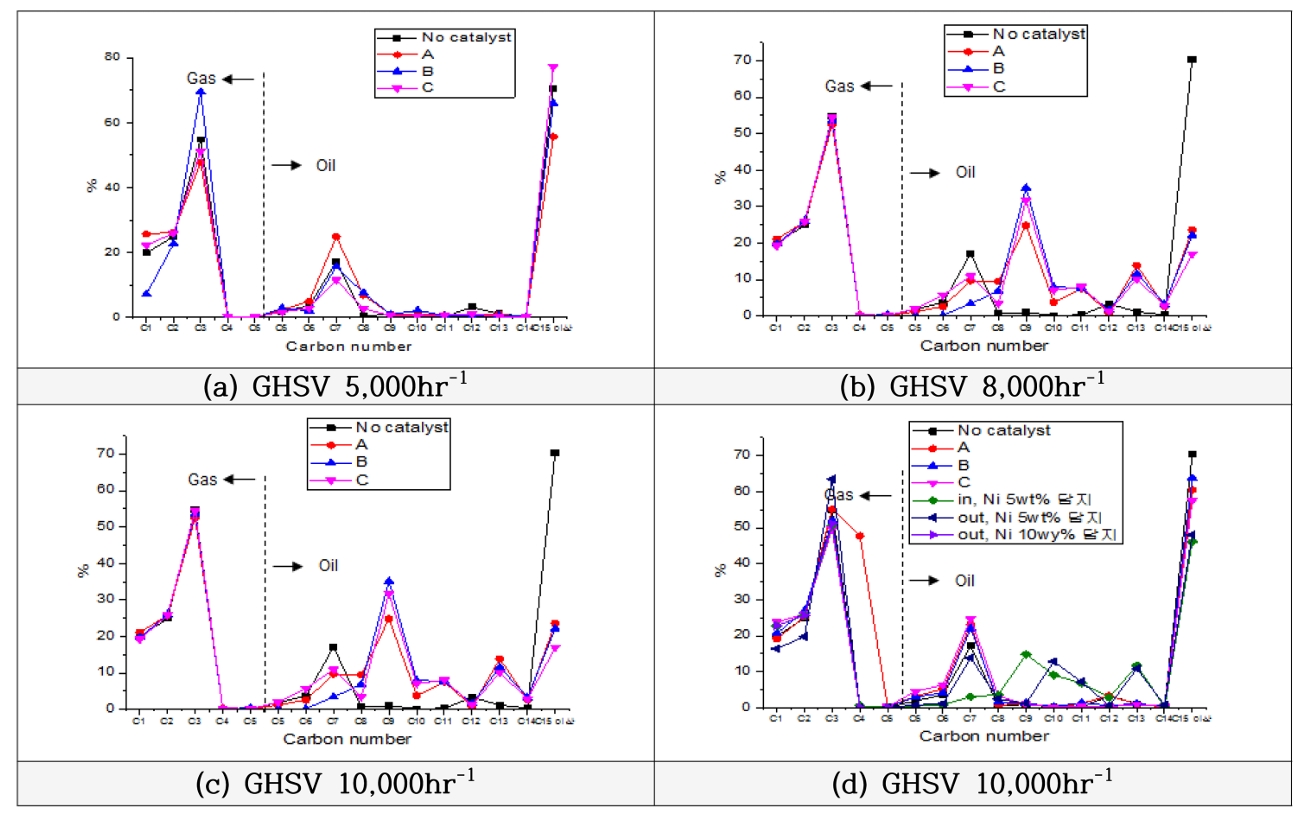
ļ░śļ®┤ņŚÉ ņŚ┤ļČäĒĢ┤ļź╝ ņłśĒ¢ēĒĢśļŖöļŹ░ ņ┤ēļ¦żļź╝ ņé¼ņÜ®ĒĢ£ Ļ▓ĮņÜ░ļōż ļ¬©ļæÉ ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØ┤ Ļ░ÉņåīĒĢśĻ│Ā, Ļ░ĆņŖżņØś ņāØņä▒ļ¤ēņØ┤ ņ”ØĻ░ĆĒĢśņśĆņ£╝ļéś C15 ņØ┤ņāüņØś ĒāäĒÖöņłśņåīĻ░Ć ņżäĻ│Ā C5~C14Ļ░Ć ņ”ØĻ░ĆĒ¢łļŗż. Fig. 13ņØä ļ│┤ļ®┤ Ļ│ĄĻ░äņåŹļÅä 5,000 hr-1ļĪ£ ņ┤ēļ¦żņØś ņ¢æņØä Ļ▓░ņĀĢĒĢ£ Ļ▓ĮņÜ░ ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØĆ Cņé¼ņØś FCC(Fluid Catalytic Cracking)ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ ņŚ┤ļČäĒĢ┤ļŖö 49.56 wt%, Bņé¼ņØś FCCņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ 43.64 wt%, Aņé¼ņØś FCCņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ 12.48 wt% ņł£ņØ┤ņŚłņ£╝ļéś, C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØĆ 22.80%ļĪ£ Cņé¼ņØś FCC ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░Ļ░Ć Ļ░Ćņן ņĀüņŚłĻ│Ā, ņ┤ēļ¦ż Aņé¼ņØś FCCņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ┤ C5~C14ņØś ĒāäĒÖöņłśņåīļŖö 44.29%ļĪ£ Ļ░Ćņן ļ¦ÄņØ┤ ņāØņä▒ļÉśņŚłļŗż.
ĻĘĖļ¤¼ļéś Aņé¼ņØś FCCņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØ┤ 12.48 wt%ļĪ£ ļ¦żņÜ░ ņĀüņ¢┤ ņŗżņĀ£ ņāØņä▒ļÉ£ C5~C14ņØś ĒāäĒÖöņłśņåīņØś ņāØņä▒ļ¤ēņØĆ ļ¦żņÜ░ ņĀüņŚłļŗż.
ņ┤ēļ¦żņØś ņ¢æņØä Ļ│ĄĻ░äņåŹļÅä 8,000 hr-1ļĪ£ ņäżņĀĢĒĢśņŚ¼ ņŚ┤ļČäĒĢ┤ ņŗżĒŚśņØä ņłśĒ¢ēĒĢ£ Ļ▓░Ļ│╝ļĪ£, Ļ│ĄĻ░äņåŹļÅä 8,000 hr-1ņØś ņĪ░Ļ▒┤ņŚÉņä£ļÅä ņśżņØ╝ ņāØņä▒ļ¤ēņØ┤ Cņé¼ņØś FCCņ┤ēļ¦ż, Bņé¼ņØś FCCņ┤ēļ¦ż, Aņé¼ņØś FCCņ┤ēļ¦ż ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ ņł£ņä£ņśĆļŗż. ļśÉĒĢ£ C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ļÅä Cņé¼ņØś FCCņ┤ēļ¦ż, Bņé¼ņØś FCCņ┤ēļ¦ż, Aņé¼ņØś FCCņ┤ēļ¦ż ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ ņł£ņä£ļĪ£ Ļ░üĻ░ü 82.98%, 77.83%, 76.43%ļĪ£ ļŗżļźĖ ņĪ░Ļ▒┤ņØś Ļ│ĄĻ░äņåŹļÅäļōżņŚÉ ļ╣äĒĢ┤ ļåÆņØĆ ļ╣äņ£©ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż.
ĻĖ░ņ▓┤Ļ│ĄĻ░äņåŹļÅä 10,000 hr-1ļĪ£ ņ┤ēļ¦żņØś ņ¢æņØä Ļ▓░ņĀĢĒĢ£ ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØ┤ Bņé¼ņØś FCCņ┤ēļ¦ż, Aņé¼ņØś FCCņ┤ēļ¦ż, Cņé¼ņØś FCCņ┤ēļ¦żļź╝ Ļ░üĻ░ü ņ┤ēļ¦żļĪ£ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ ņł£ņ£╝ļĪ£ ļéśĒāĆļé¼Ļ│Ā, C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØĆ Cņé¼ņØś FCCņ┤ēļ¦żļź╝ ņ┤ēļ¦żļĪ£ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ 42.38%, Aņé¼ņØś FCCņ┤ēļ¦żļź╝ ņ┤ēļ¦żļĪ£ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ 39.47%, Bņé¼ņØś FCCņ┤ēļ¦ż ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ 36.16% ņł£ņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż.
ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ┤ ņŚ┤ļČäĒĢ┤ Ļ│ĄņĀĢņØä ņłśĒ¢ēĒĢśļ®┤ ņ┤ēļ¦żņØś Ļ│ĄĻ░äņåŹļÅäņŚÉ ļö░ļØ╝ ļ╣äĻĄÉĒĢ┤ ļ│Ė Ļ▓░Ļ│╝ ņśżņØ╝ ņāØņä▒ļ¤ēņØś Ļ▓ĮņÜ░ Ļ│ĄĻ░äņåŹļÅä 10,000 hr-1ņĪ░Ļ▒┤ņŚÉņä£ ĒÅēĻĘĀ 57.61 wt%ļĪ£ Ļ░Ćņן ļ¦ÄņØĆ ņ¢æņØ┤ ņāØņä▒ļÉśņŚłĻ│Ā 8,000 hr-1, 4,000 hr-1ņĪ░Ļ▒┤ņŚÉņä£ Ļ░üĻ░ü ĒÅēĻĘĀ 49.55 wt%, 35.23 wt% ņł£ņ£╝ļĪ£ ņśżņØ╝ņØ┤ ņāØņé░ļÉśņŚłļŗż. ĒĢśņ¦Ćļ¦ī C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØä ļ╣äĻĄÉĒĢśļ®┤ 8,000 hr-1, 10,000 hr-1, 4,000 hr-1ņØś Ļ│ĄĻ░äņåŹļÅä ņł£ņä£ļĪ£ 79.08%, 39.34%, 33.68%ņØś C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż.
ĒĢ®ņä▒ņśżņØ╝(C5~C14)ņØś ĒāäĒÖöņłśņåīļź╝ ĒżĒĢ©ĒĢ£ ņśżņØ╝ ņāØņé░ņØä ņ£äĒĢ┤ Ļ│ĄĻ░äņåŹļÅä 8,000 hr-1ņŚÉņä£ Cņé¼ņØś FCC(Fluid Catalytic Cracking) ņĀüņÜ®ĒĢśļŖö Ļ▓āņØ┤ ņĀüĒĢ®ĒĢśļŗżĻ│Ā ĒīÉļŗ©ļÉśņŚłļŗż. ņÖ£ļāÉĒĢśļ®┤, ļČłņł£ļ¼╝Ļ│╝ ĒāäĒÖöņłśņåīĻ▓░ĒĢ®ņØä ņĀüņØĆ ņŚÉļäłņ¦ĆļĪ£ ļüŖņØä ņłś ņ׳ļŗżļŖö ņןņĀÉņØ┤ ņ׳ņ£╝ļ®░, ļśÉĒĢ£, ņ¦Ćļ░®ņĪ▒ ļČłĒżĒÖö ĒāäĒÖöņłśņåī(alkyne)ļ░śņØæņŚÉņä£ alkene ļ░śņØæņŚÉņä£ ņēĮĻ▓ī ļÅäņÖĆņŻ╝ļŖö ņŚŁĒĢĀņØä ĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ņ┤ēļ¦żļōżĻ│╝ silica sandņŚÉ NiņØä ļŗ┤ņ¦ĆĒĢ£ ņ┤ēļ¦żņØś ņāØņä▒ļ¤ēņØä ļ╣äĻĄÉĒĢśĻ│Āņ×É silica sandņŚÉ ļŗ┤ņ¦Ć(Ni) ņ┤ēļ¦żļź╝ ņĢ×ņäĀ ņŗżĒŚśļōżĻ│╝ ļÅÖņØ╝ĒĢ£ ĻĖ░ņ▓┤Ļ│ĄĻ░äņåŹļÅä(GHSV) ņĪ░Ļ▒┤ņ£╝ļĪ£ ņŗżĒŚśņØä ņłśĒ¢ēĒĢ£ Ļ▓░Ļ│╝ ļÅäņČ£ĒĢśņśĆļŗż. Ļ│ĄĻ░äņåŹļÅä 10,000 hr-1ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ┤ēļ¦żņØś ņ¢æņØä Ļ▓░ņĀĢĒĢśņśĆņØä ļĢī silica sandņŚÉ NiņØä ļŗ┤ņ¦ĆĒĢ£ ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ņØś ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØĆ 38.87 wt%, 49.12 wt%ļĪ£ ņżäņ¢┤ļō£ļŖö Ļ▓āņØä ņĢī ņłś ņ׳ņ£╝ļéś C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØĆ 53.88%, 51.98%ļĪ£ ņ”ØĻ░Ćņŗ£ņ╝░ļŗż.
4. Ļ│ĄņĀĢņŗ£ņŖżĒģ£ ļ░Å Vapor up-grading Ļ│ĄņĀĢ
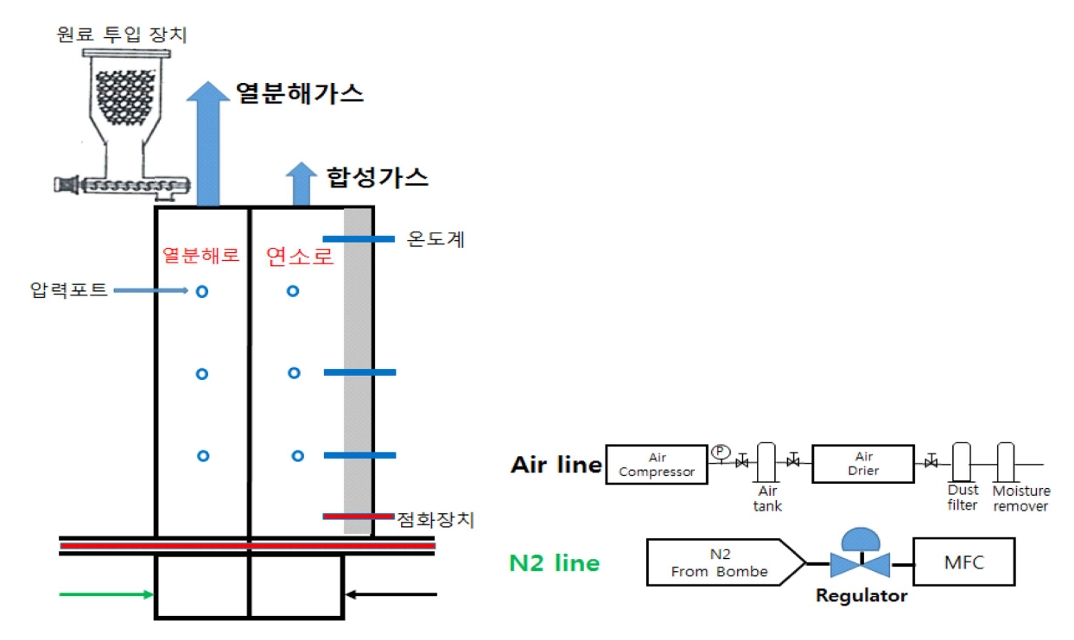
Ļ░ĆņŖżĒÖöĻĖ░ņŚÉņä£ ņŚ┤ļČäĒĢ┤ļÉ£ ņāØņä▒ļÉ£ oil vaporļź╝ Ļ░ĆņŖżņāüņŚÉņä£ ņ┤ēļ¦żņÖĆ ņĀæņ┤ēĒĢ©ņ£╝ļĪ£ņŹ© up-gradingĒĢśĻĖ░ ņ£äĒĢ┤ ņŗżĒŚśņÜ® ņ┤ēļ¦żļ░śņØæĻĖ░ļź╝ ņÜ┤ņśü ņ¦äĒ¢ēĒĢśņśĆļŗż. ņ┤ēļ¦żļ░śņØæĻĖ░ļŖö Ļ┤ĆĒśĢ ļ░śņØæĻĖ░ ĒāĆņ×ģņ£╝ļĪ£ ļööņ×ÉņØĖĒĢśņśĆņ£╝ļ®░, ņäĀņĀĢĒĢśņśĆņ£╝ļ®░ 1 inch staninless ĒŖ£ļĖī ņ¢æņ¬Į ļüØņŚÉ ĻĖłņåŹ ĒĢäĒä░ļź╝ ņäżņ╣śĒĢśņŚ¼ ļ░śņØæĻĖ░ ļé┤ļČĆ ņ┤ēļ¦żļŖö ņÖĖļČĆļĪ£ ļ╣ĀņĀĖļéśņśżņ¦Ć ļ¬╗ĒĢśĻ│Ā, Ļ░£ņ¦łļÉśņ¢┤ņ¦ä ņŚ┤ļČäĒĢ┤ Ļ░ĆņŖżļ¦ī ņØæņČĢņŗ£ņ╝░ļŗż. ņ┤ēļ¦żļ░śņØæĻĖ░ ļé┤ņŚÉņä£ ņŚ┤ļČäĒĢ┤ Ļ░ĆņŖżĻ░Ć ņ┤ēļ¦żņÖĆ ņČ®ļČäĒ׳ ņĀæņ┤ēĒĢĀ ņłś ņ׳ļÅäļĪØ ļ░śņØæĻĖ░ņØś ĻĖĖņØ┤ļź╝ 600 mmļĪ£ ņäĀņĀĢĒĢśņśĆļŗż.
ņŚ┤ļČäĒĢ┤ Ļ░ĆņŖżĻ░Ć ņ┤ēļ¦żņÖĆ ņĀæņ┤ēĒĢśļŖö ļÅÖņĢł Ļ░ĆņŖżņāüņØä ņ£Āņ¦ĆĒĢśļÅäļĪØ Ļ░ĆņŚ┤ļĪ£ļź╝ ņäżņ╣śĒĢśņśĆņ£╝ļ®░, Ļ░ĆņŚ┤ļĪ£ļŖö ņĄ£ļīĆ 700ŌäāĻ╣īņ¦Ć ņŖ╣ņś©ņØ┤ Ļ░ĆļŖźĒĢśļ®░ ņś©ļÅä ņĀ£ņ¢┤Ļ░Ć Ļ░ĆļŖźĒĢśļÅäļĪØ ņäżĻ│äĒĢśņśĆļŗż. ņĄ£ļīĆ ņś©ļÅä 1,200ŌäāĻ╣īņ¦Ć ņŖ╣ņś©ĒĢĀ ņłś ņ׳ļÅäļĪØ ņäżĻ│äļÉśņ¢┤ ņ׳ņ£╝ļ®░ N2ņØś ņ£Āļ¤ēņØĆ MFC(Mass Flow Controller)ņØä ņé¼ņÜ®ĒĢśņŚ¼ ņĪ░ņĀłĒĢśņśĆļŗż. PLC ĒīÉļä¼ņŚÉ ņØśĒĢśņŚ¼ Ēö╝ļŹö, furnace, ring blower ņĪ░ņĀłņØ┤ Ļ░ĆļŖźĒĢśļÅäļĪØ ņĀ£ņ×æĒĢśņśĆņ£╝ļ®░, ļ░śņØæĻĖ░ ņś©ļÅäĻ░Ć ņäżņĀĢņś©ļÅäļź╝ ļäśņ¢┤ņä£ļ®┤ ņ×ÉļÅÖņ£╝ļĪ£ furnaceĻ░Ć ņĀĢņ¦ĆļÉśļÅäļĪØ ņäżņĀĢĒĢśņśĆļŗż.
Ļ░ĆņŖż ņĀĢņĀ£ ņäżļ╣äļŖö ļ░śņØæĻĖ░ ņāüļČĆ Ļ░ĆņŖż ņŚ░ļÅäļź╝ ņ¦Ćļéś ņŗĖņØ┤Ēü┤ļĪĀ Ēøäļŗ©ņŚÉņä£ ņŚ┤ļČäĒĢ┤ Ļ░ĆņŖżĻ░Ć ņĀäĻĖ░ ņ¦æņ¦äĻĖ░ņŚÉ Ēżņ¦æļÉśļÅäļĪØ ņäżņ╣śĒĢśņśĆļŗż. ņØæņČĢ ņןņ╣śļŖö ņŚÉĒāäņś¼/ļ¼╝ņØä ņé¼ņÜ®ĒĢśņŚ¼ ņĀĆņś©(-10Ōäā)ņ£╝ļĪ£ ļāēĻ░üņŗ£ņ╝£ ņŚ┤ļČäĒĢ┤ ņśżņØ╝ņØ┤ ņØæņČĢļÉśļÅäļĪØ ņÜ┤ņĀäĒĢśņśĆņ£╝ļ®░, ņĀäĻĖ░ņ¦æņ¦äĻĖ░ļź╝ ņ×æļÅÖĒĢśņŚ¼ ņŚ┤ļČäĒĢ┤ Ļ░ĆņŖżņŚÉ ĒżĒĢ©ļÉśņ¢┤ ņ׳ļŖö ņśżņØ╝ ņä▒ļČäņØ┤ ņĄ£ļīĆĒĢ£ Ēżņ¦æļÉĀ ņłś ņ׳ļÅäļĪØ ņÜ┤ņĀäĒĢśņśĆļŗż.
5. ņ┤ēļ¦żņŚÉ ļö░ļźĖ Ļ│ĄĻ░äņåŹļÅä(GHSV) Ļ▓░Ļ│╝ ļ╣äĻĄÉ
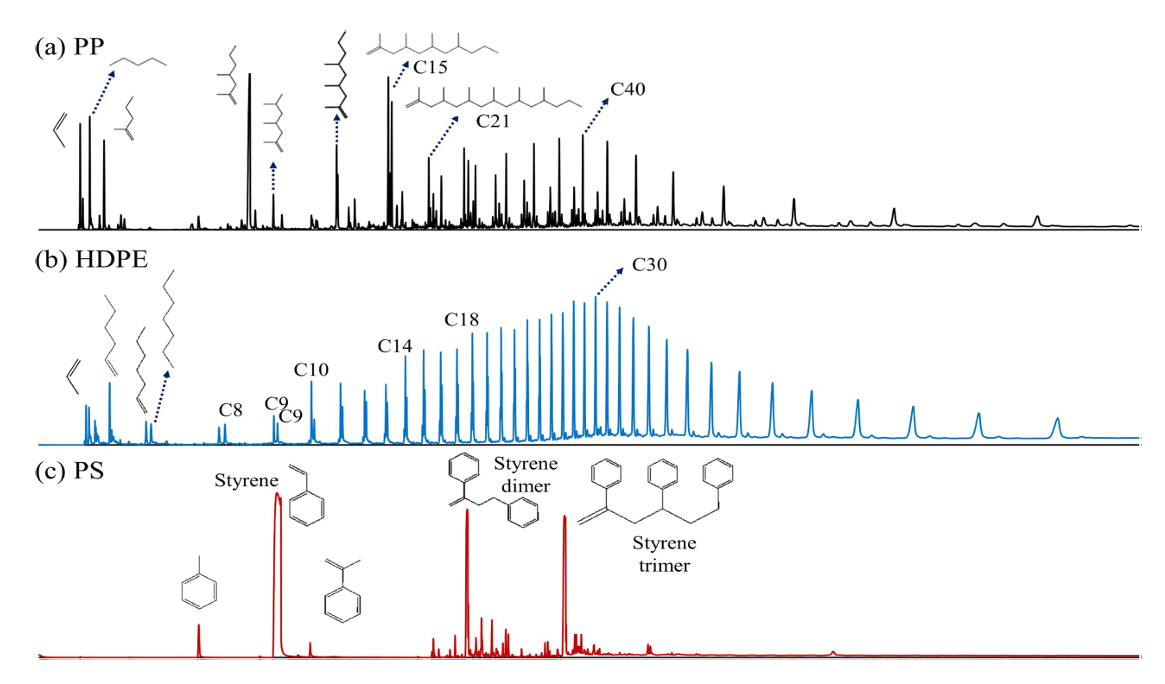
ņŚ┤ļČäĒĢ┤ ĒÖöĒĢ®ļ¼╝ņØĆ UA-5 columnņØä ņé¼ņÜ®ĒĢśņŚ¼ ļČäļ”¼ĒĢśņśĆļŗż. ļśÉĒĢ£ ļ╣äņĀÉņØ┤ ļé«ņØĆ ĒÖöĒĢ®ļ¼╝ņØś ļČäļ”¼ļŖź Ē¢źņāüņØä ņ£äĒĢ┤ MicroJet Cryo-TrapņØä ņé¼ņÜ®ĒĢśņŚ¼ -196ŌäāņØś ņĢĪĒÖö ņ¦łņåīļź╝ column ņĢ×ļŗ©ļČĆņŚÉ Ļ│ĄĻĖēĒĢśņśĆļŗż. GC/MSļź╝ ņØ┤ņÜ®ĒĢ£ ĒÅÉļ╣äļŗÉņØś ļō▒ņś© ņŚ┤ļČäĒĢ┤ ņāØņä▒ļ¼╝ ļČäņäØ Ļ▓░Ļ│╝, PS, PE, PP, PETņÖĆ phthalate Ļ░ÖņØĆ ĒöīļØ╝ņŖżĒŗ▒ Ļ│äņŚ┤ņØś ņŚ┤ļČäĒĢ┤ ņāØņä▒ļ¼╝ņØ┤ ļ¬©ļæÉ ļéśĒāĆļé¼ņ£╝ļ®░, ņŚ┤ļČäĒĢ┤ ņāØņä▒ļ¼╝ļÅä ļéśĒāĆļé¼ņ£╝ļéś, ņŚ┤ļČäĒĢ┤ ļČĆņé░ļ¼╝ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ļö░ļØ╝ņä£ ĒÅÉļ╣äļŗÉņØś ņ┤łĻĖ░ ļČäĒĢ┤ļŖö Starch ņŚ┤ļČäĒĢ┤ņŚÉ ĻĖ░ņØĖĒĢśņśĆņØīņØä ņĢī ņłś ņ׳ņŚłļŗż.
Ļ▓░ļĪĀ
ĒÅÉĒöīļØ╝ņŖżĒŗ▒(PE, PP, PS)ļŖö Ē£śļ░£ļČä, ļ░£ņŚ┤ļ¤ē, ĒāäĒÖöņłśņåī ļō▒ ĒĢ©ļ¤ēņØä ņ¦Ćļģöņ£╝ļ®░, ņé░ņåīĻ░Ć ĒĢ©ņ£ĀļÅ╝ ņ׳ņØīņØä ņĢī ņłś ņ׳ļŗż. TGA ļČäņäØ Ļ▓░Ļ│╝ ĒÅÉĒöīļØ╝ņŖżĒŗ▒ņØĆ 350~550ŌäāņŚÉņä£ ņŻ╝ļĪ£ ņŚ┤ļČäĒĢ┤ļÉśĻ│Ā Ļ│Āņ▓┤ļČĆņé░ļ¼╝ņØĆ Ļ▒░ņØś ņĪ┤ņ×¼ĒĢśņ¦Ć ņĢŖņĢśļŗż. Ļ│ĄĻ░äņåŹļÅä 8,000 hr-1ņ£╝ļĪ£ ĒĢśņśĆņØä Ļ▓ĮņÜ░, C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØ┤ 75~83%ļĪ£ Ļ░Ćņן ļåÆņĢśļŗż. Silica sandņŚÉ NiņØä ļŗ┤ņ¦ĆĒĢ£ ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ļŖö ņāüņÜ® ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢ┤ ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØĆ 10 wt% ņØ┤ņāü ņĀüĻ▓ī ļéśĒāĆļé¼ņ£╝ļéś, C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØ┤ 50% ņØ┤ņāüņ£╝ļĪ£ ņāüņÜ® ņ┤ēļ¦żļ│┤ļŗż ļåÆņØĆ ņāØņä▒ļ¤ēņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. Silica sandņŚÉ NiņØä ļŗ┤ņ¦ĆĒĢ£ ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ ņŚ┤ļČäĒĢ┤ ņŗżĒŚśņØĆ ņāØņä▒ļ¼╝ ļČäņäØ Ļ▓░Ļ│╝ņÖĆ ļŗżņ¢æĒĢ£ Ļ│ĄĻ░äņåŹļÅäņÖĆ silica sandņŚÉ NiĻ│╝ ņĪ░ņ┤ēļ¦żņØś ļ¼┤Ļ▓īļ╣äņŚÉ ļö░ļźĖ ņ┤ēļ¦żņØś ĒŖ╣ņä▒ņØä ļ╣äĻĄÉĒĢĀ ņłś ņ׳ņŚłļŗż.
ĻĘĖ Ļ▓░Ļ│╝ ĒĢ®ņä▒ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØĆ ņ┤ēļ¦żļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ņŚÉ 70.2 wt%ļĪ£ Ļ░Ćņן ļ¦ÄņĢśņ£╝ļéś, ņāØņä▒ļÉ£ ĒĢ®ņä▒ņśżņØ╝ņØś ņä▒ļČä ņżæ ĒāäĒÖöņłśņåīĻ░Ć 15Ļ░£ ņØ┤ņāüņØś ņÖüņŖżņä▒ļČäņØś ĒāäĒÖöņłśņåīĻ░Ć 70.47%ļź╝ ņ░©ņ¦ĆĒĢśĻ│Ā ņ׳ļŗż. ĻĘĖņŚÉ ļ░śĒĢ┤ ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ ņśżņØ╝ ņāØņä▒ļ¤ēņØ┤ ņżäņ¢┤ļō£ļéś ņśżņØ╝ ņä▒ļČä ņżæ C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØ┤ ņ”ØĻ░ĆĒĢśņśĆļŗż. ņ┤ēļ¦żņØś ņ¢æņØä Ļ│ĄĻ░äņåŹļÅä 10,000 hr-1, 8,000 hr-1, 4,000 hr-1ņĪ░Ļ▒┤ņŚÉ ļö░ļØ╝ Ļ▓░ņĀĢĒĢśņŚ¼ ņŚ┤ļČäĒĢ┤ļź╝ ĒĢ£ Ļ▓░Ļ│╝ Ļ│ĄĻ░äņåŹļÅä 10,000 hr-1ņ£╝ļĪ£ ĒĢśņśĆņØä Ļ▓ĮņÜ░ņŚÉļŖö ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØ┤ ļŗżļźĖ ļæÉ ņĪ░Ļ▒┤ļ│┤ļŗż ļ¦ÄņØ┤ ļéśņÖöņ£╝ļéś C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØ┤ 30~40%ļĪ£ ņĀüņŚłļŗż. ļ░śļ®┤ņŚÉ Ļ│ĄĻ░äņåŹļÅä 8,000 hr-1ņ£╝ļĪ£ ĒĢśņśĆņØä Ļ▓ĮņÜ░, C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØ┤ 75~83%ļĪ£ Ļ░Ćņן ļåÆņĢśļŗż. Silica sandņŚÉ NiņØä ļŗ┤ņ¦ĆĒĢ£ ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ļŖö ņāüņÜ® ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢ┤ ņśżņØ╝ņØś ņāØņä▒ļ¤ēņØĆ 10 wt% ņØ┤ņāü ņĀüĻ▓ī ļéśĒāĆļé¼ņ£╝ļéś, C5~C14ņØś ĒāäĒÖöņłśņåīņØś ļ╣äņ£©ņØ┤ 50% ņØ┤ņāüņ£╝ļĪ£ ņāüņÜ® ņ┤ēļ¦żļ│┤ļŗż ļåÆņØĆ ņāØņä▒ļ¤ēņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print